
【题目】化合物M的结构如图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的核外电子数是Y的两倍。下列说法正确的是( )
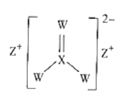
A.简单离子的半径:W>Z>Y
B.最简单氢化物的沸点:W>X>Y
C.Y、W均能和Z形成两种化合物
D.W的单质不能溶于XW2
【答案】C
【解析】
离子化合物M中Z为+1价且原子序数较大,则Z为Na;X形成4个共价键且原子序数最小,则X为C;根据化合价可知W显-2价,且W的原子序数最大,则W是S;W的核外电子数是Y的两倍,则Y为O;综上所述,X、Y、Z、W分别是C、O、Na、S,据此解答。
A.O2-和Na+核外有2个电子层,S2-核外有三个电子层,S2-半径最大,O2-的核电荷数比Na+小,则O2-的半径大于Na+的半径,即离子半径:W(S2-)>Y(O2-)>Z(Na+),A错误;
B.Y(O)的简单氢化物为H2O,常温下为液态,X(C)、W(S)的简单氢化物为CH4、H2S,二者常温下为气态,即Y(O)的简单氢化物沸点最高,B错误;
C.Y、W均能和Z形成两种化合物,即Na2O、Na2O2、Na2S、Na2S2,C正确;
D.W为S、X为C,W(S)单质易溶于XW2(CS2),D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】常温时,l mol·L-1的HClO2和1 mol·L-1的HMnO4两种溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B.在0≤pH≤5时,HMnO4溶液满足:pH=![]()
C.等pH的HClO2和HMnO4分别与足量Zn反应放出H2的体积HClO2>HMnO4
D.稀释前分别用l mol·L-1的NaOH溶液中和,消耗NaOH溶液的体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
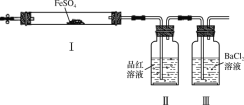
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该试剂的物质的量浓度为9.2 mol·L-1
B.该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体
C.配制200 mL 4.6mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和乙醇反应制取乙酸乙酯的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上。回答下列问题:
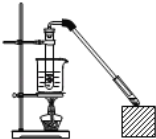
(1)乙酸的官能团是____(写名称)。制取乙酸乙酯的化学方程式为:___。
(2)①浓H2SO4的作用是____。
②小试管中的溶液是____,其作用是____(写出一种即可);
③长导管不插入液面以下的目的是____;
(4)实验中采取的加热方式称,这种加热方式的好处主要有____、___;
(5)反应生成的乙酸乙酯,其密度比水___(填“大”或“小”),有___气味。应从该分液漏斗的___(填编号,多填、少填均不得分)。
a.下部流出 b.上口倒出 c.都可以
(6)若实验室中温度过高,温度达170℃,副产物中主要有机产物是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,常见有![]() 和
和![]() 等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备![]() 的主要流程:
的主要流程:
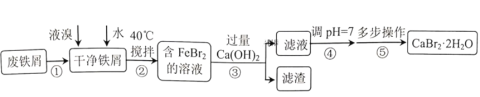
相关信息如下:
①![]() 吸湿性强。
吸湿性强。
②34℃时结晶得到![]() ,
,![]() 加热至210℃得到
加热至210℃得到![]() 。
。
请回答:
(1)步骤①的目的是去除废铁屑表面的油污,方法是________。
(2)实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其正确操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。________
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
(3)步骤④调pH=7,适宜加入的试剂是________,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的________(填序号)所示。

(4)下列有关说法正确的是________。
A.步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发
B.步骤③滤渣成分只有![]() 、
、![]() 和
和![]()
C.为使![]() 快速结晶,可用冰水浴进行冷却
快速结晶,可用冰水浴进行冷却
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
(5)制得的![]() 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
若实验操作规范而测定结果偏低,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:BF3和水反应生成氟硼酸(HBF4)和硼酸(H3BO3),一定条件下BF3与一定量水可形成![]() 晶体Q(
晶体Q(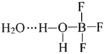 )。下列有关说法,正确的是
)。下列有关说法,正确的是
A.BF3和水反应生成氟硼酸和硼酸是氧化还原反应
B.BF3分子中,每个原子的最外层都具有8电子稳定结构
C.晶体Q中存在离子键、共价键、范德华力和氢键
D.H3BO3在水中只发生反应:![]() ,可知硼酸是一元酸
,可知硼酸是一元酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com