
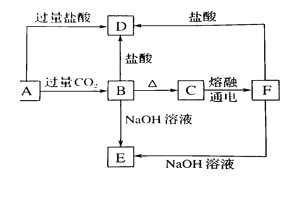
【题目】A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
(1)写出化学式;
A______ ,C______ ,D______ ,E______
(2)写出下列反应的离子方程式:
①A→B: _____________________________________________
②B→E: _____________________________________________
③C→E: _____________________________________________
④F→E: _____________________________________________
【答案】KAlO2 Al2O3 AlCl3 NaAlO2 AlO2-+CO2+2H2O= Al(OH)3↓ + HCO3- Al(OH)3+OH-=AlO2-+2H2O Al2O3+2OH-=2AlO2-+H2O 2Al+2H2O+2OH-=2AlO2-+3H2↑
【解析】
根据图像,B、F均可与酸、碱反应,且电解熔融状态的C,可以生成F,则F为Al,则C为氧化铝,B为氢氧化铝,E为偏铝酸钠;D为氯化铝;A溶液灼烧,焰色反应为浅紫色,A中含有K元素,则A为偏铝酸钾。
(1)分析可知,A为偏铝酸钾,化学式为KAlO2;C为氧化铝,化学式为Al2O3;D为氯化铝,化学式为AlCl3;E为偏铝酸钠,化学式为NaAlO2;
(2)①偏铝酸钾与过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钾,离子方程式为AlO2-+CO2+2H2O= Al(OH)3↓ + HCO3-;
②氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
③氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
④铝与氢氧化钠反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑。


科目:高中化学 来源: 题型:
【题目】已知A、F为金属单质,C是淡黄色粉末,回答下题。
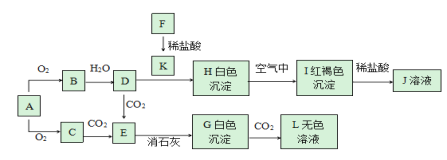
(1)实验室中A常常保存在__中,若将0.1molC直接转化成D,转移电子数为__个。
(2)写出D与J混合的离子反应方程式__。
(3)用化学方程式表示沉淀H转化成I颜色发生变化的原因:__。
(4)直接向K溶液中加入C固体,写出可能出现的现象:__。
(5)向盛有L溶液的水槽中加入一小块金属A,下列现象描述不符合实际情况的是__。
a.金属A浮在液面,并四处游动
b.金属A会熔化成一个小球
c.反应开始后,溶液由无色变成红色
d.恢复到室温时,烧杯底部有固体物质析出
(6)0.12molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃烧时的能量变化如图,有关说法正确的是( )
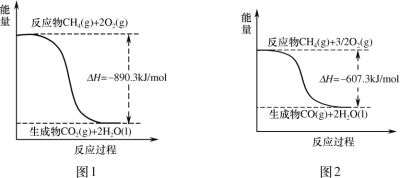
A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+![]() O2(g)=CO2(g) H=﹣283kJ/mol
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
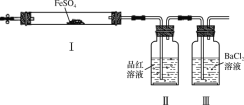
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)写出下列物质在水溶液中的电离方程式:
H2SO4:___ Ba(OH)2:____
Al2(SO4)3:___ NaHSO4:______
NaHCO3:___
(2)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①用“双线桥法”标出下列氧化还原反应电子转移情况。___。
②还原剂是___,氧化产物是___。
③氧化剂与还原产物的物质的量之比为___。当生成2mol的NO2时,转移电子物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HF和CH3COOH的电离常数分别为3.5×10-4和1.7×10-5。将pH和体积均相同的NaF和CH3COONa溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
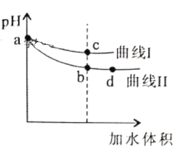
A.曲线I代表CH3COONa溶液
B.溶液中水的电离程度:c点>b点
C.从b点到d点,溶液中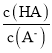 保持不变(其中HA、
保持不变(其中HA、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与HCl恰好反应后,溶液中![]() 相同
相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com