
【题目】根据下表中的键能,可计算出甲烷的燃烧热为( )
![]()
A.379kJ/molB.808kJ/molC.1656kJ/molD.2532kJ/mol
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2;CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是( )
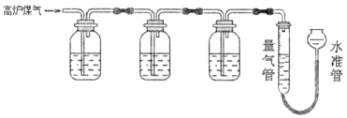
A.采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B.保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C.当三种气体被逐一吸收后,导出的气体中可能含有HCl
D.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,l mol·L-1的HClO2和1 mol·L-1的HMnO4两种溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B.在0≤pH≤5时,HMnO4溶液满足:pH=![]()
C.等pH的HClO2和HMnO4分别与足量Zn反应放出H2的体积HClO2>HMnO4
D.稀释前分别用l mol·L-1的NaOH溶液中和,消耗NaOH溶液的体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃烧时的能量变化如图,有关说法正确的是( )
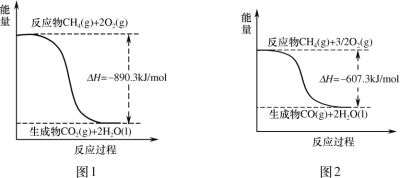
A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+![]() O2(g)=CO2(g) H=﹣283kJ/mol
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
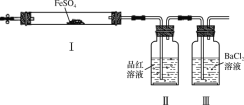
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,常见有![]() 和
和![]() 等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备![]() 的主要流程:
的主要流程:
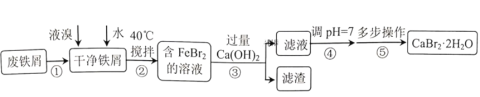
相关信息如下:
①![]() 吸湿性强。
吸湿性强。
②34℃时结晶得到![]() ,
,![]() 加热至210℃得到
加热至210℃得到![]() 。
。
请回答:
(1)步骤①的目的是去除废铁屑表面的油污,方法是________。
(2)实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其正确操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。________
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
(3)步骤④调pH=7,适宜加入的试剂是________,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的________(填序号)所示。

(4)下列有关说法正确的是________。
A.步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发
B.步骤③滤渣成分只有![]() 、
、![]() 和
和![]()
C.为使![]() 快速结晶,可用冰水浴进行冷却
快速结晶,可用冰水浴进行冷却
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
(5)制得的![]() 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
若实验操作规范而测定结果偏低,其可能的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com