
【题目】某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积为25.0 mL。(提示:2Fe3++Cu=2Fe2++Cu2+,8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O。)
(1)计算该铁矿石中铁元素的质量分数。_____
(2)计算氧化物FemOn的化学式(m、n为正整数)。_______
【答案】56% Fe5O7(或FeO·2Fe2O3)
【解析】
铁矿石中加入稀硫酸充分溶解,FemOn与稀硫酸反应生成硫酸铁和硫酸亚铁的混合液,加入铜粉后溶液中Fe3+与铜完全反应,Fe3+全部转变为Fe2+,用浓度为2 mol·L-1的酸性KMnO4滴定,溶液中Fe2+全部被氧化,Fe2+全部转变为Fe3+。
(1)由题意可知,样品中的铁元素在加入铜粉后全部转变为Fe2+,由方程式8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O可知,溶液中n(Fe2+)=5 n(MnO4—)=5×2molL-1×0.025L=0.25mol,根据铁原子个数守恒可知氧化物中铁元素的质量等于Fe2+的质量为0.25mol×56g/mol=14g,所以铁矿石中铁元素的质量分数为![]() ×100%=56%,故答案为:56%;
×100%=56%,故答案为:56%;
(2)由题意可知参加反应的铜的质量为10g-3.6g=6.4g,反应铜物质的量n(Cu)=![]() =0.1mol,由方程式2Fe3++Cu=2Fe2++Cu2+可知,溶液中n(Fe3+)=2n(Cu) =0.2mol,则溶液中n(Fe2+)=0.25mol-0.2mol=0.05mol,所以铁的氧化物中n(Fe3+):n(Fe2+)=0.2mol:0.05mol=4:1,故该铁氧化物可表示为2Fe2O3FeO或Fe5O7,故答案为:Fe5O7(或FeO·2Fe2O3)。
=0.1mol,由方程式2Fe3++Cu=2Fe2++Cu2+可知,溶液中n(Fe3+)=2n(Cu) =0.2mol,则溶液中n(Fe2+)=0.25mol-0.2mol=0.05mol,所以铁的氧化物中n(Fe3+):n(Fe2+)=0.2mol:0.05mol=4:1,故该铁氧化物可表示为2Fe2O3FeO或Fe5O7,故答案为:Fe5O7(或FeO·2Fe2O3)。


科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
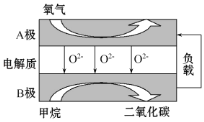
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;若外电路只通过了0.06mol电子,且阴极产生气体在标准状况下的体积为224mL,要使原溶液复原,可向电解后的溶液中加入____________。
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
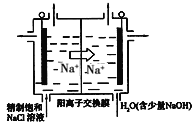
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式_________________________________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为______;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B的基态原子的轨道表达式为______,C元素的离子结构示意图为______。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为_____,其基态原子的电子排布式为______,它位于第________周期第______族;
(4)E元素基态原子的M层能量最高的能级半充满,N层没有成对电子,只有一个未成对电子,E的元素符号为_____________,其基态原子的价电子排布式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子轨道排布图:_________________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是___________(填序号)。
A.甲的金属性比乙强 B.乙有![]() 价
价
C.丙不可能为非金属元素 D.丁一定为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某无色溶液用激光笔照射无丁达尔现象,加入FeCl3后溶液显色.下列各组微粒在此溶液可以大量共存的是
A.Na+、K+、Fe2+、Cl-
B.K+、Fe2+、NO3-、Fe(OH)3(胶体)
C.Cl-、SCN-、NH4+、葡萄糖分子
D.OH-、Na+、苯酚、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
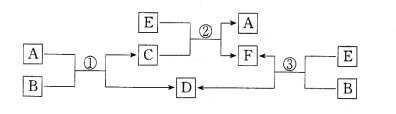
(1)若B是水,C是一种有磁性的黑色化合物,则反应①的化学方程式为_______。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环,反应①的离子方程式是______________________________________。在反应③中,若生成1 mo1 D,则转移电子数目为______________。
(3)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为_________________,其中A的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如下:

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是____________;“滤渣1”的主要成分为____________。
(2)“转化Ⅰ”的目的为___________________(用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为__________________。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,________(选填“能”或“不能”)达到目的,“试剂X”可以是________(填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________;“转化Ⅱ”中发生反应的离子方程式为________。
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置连接好后,电流计指针发生了偏转,下列说法中正确的是
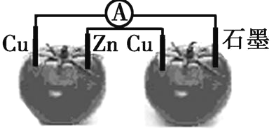
A.两个番茄及相关电极均构成了原电池
B.锌是负极
C.电子移动:锌→铜(右)→番茄→石墨→铜(左)
D.两个铜片上均发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com