
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
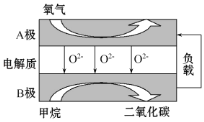
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;若外电路只通过了0.06mol电子,且阴极产生气体在标准状况下的体积为224mL,要使原溶液复原,可向电解后的溶液中加入____________。
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
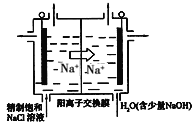
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式_________________________________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
【答案】.CH4-8e-+4O2-=CO2+2H2O 4 AC 右 Cl--5e-+2H2O=ClO2+4H+ 0.01NA
【解析】
(1)B极上是甲烷发生氧化反应,生成二氧化碳,由此书写电极反应式;
(2)电解时阳极是水电离出的氢氧根离子放电,生成氧气,由此书写电极反应式;根据整个电路转移电子的物质的量相等分析解答;电解质复原:出什么加什么,据此回答;
(3)①根据钠离子的移动方向可知a极为电解池的阳极,与电源的正极相连接,故接右边,在阳极为氯离子放电,且生成物为ClO2,由此书写电极反应式;
②H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×0.112L÷22.4L/mol=0.01mol,则在内电路中移动的电荷为0.01mol,由此分析解答。
(1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为.CH4-8e-+4O2-=CO2+2H2O
故答案为:.CH4-8e-+4O2-=CO2+2H2O
(2)用惰性电解硫酸铜溶液时,阳极为水电离的OH-放电,电极反应式为:2H2O-4e-=4H++O2↑,当阳极产生11.2L气体时,转移的电子为11.2L÷22.4L/mol×4=2mol,由电子守恒可得甲醇的质量为2mol÷8××16g/mol=4g,在电解硫酸铜溶液的过程中,阴极析出铜,阳极析出氧气,若要使溶液复原,根据原子守恒可知应向溶液中加入CuO或CuCO3,根据计算可知答案;故答案为:4;AC;
(3)①根据钠离子的移动方向可知左边为电解池的阳极,与电源的正极相连接,故接右边,在阳极为氯离子放电,且生成物为ClO2,则电极反应为:Cl--5e-+2H2O=ClO2+4H+ ,故答案为:右边;Cl--5e-+2H2O=ClO2+4H+ ;
②H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×0.112L/22.4L/mol
=0.01mol,则在内电路中移动的电荷为0.01mol,通过阳离子交换膜的阳离子的数目为0.01NA,故答案为:0.01NA


科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是______________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案_____________________。
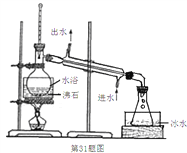
(3)蒸馏装置如下图所示,装置中存在的错误是_______________________________。
(4)滴定前,加入的适量溶液B是_________。
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为____________。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:HCO3-、K+、Cl-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+ 、SO42-
C.在c (H+)/c (OH-)=1×1012的溶液中:NH4+、Ca2+、Cl-、K+
D.在酸性溶液中:K+、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。

请回答:
(1)加入的A是__________,检验A已过量的方法是___________。
(2)加入的B是__________,加入稍过量B的目的是__________。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.l mol ·L1的H2SO4溶液:NH4+、Fe2+、Cl、NO3-
B.0.l mol ·L1的FeCl3溶液:K+、Al3+、SO42-、NO3-
C.0.l mol ·L1的Na2SO3溶液:Ba2+、K+、ClO-、MnO4-
D.0.l mol ·L1的Ba(OH)2溶液:Mg2+、Na+、HCO3-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积为25.0 mL。(提示:2Fe3++Cu=2Fe2++Cu2+,8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O。)
(1)计算该铁矿石中铁元素的质量分数。_____
(2)计算氧化物FemOn的化学式(m、n为正整数)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,向20 mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
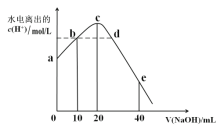
A.从a到c,醋酸的电离始终受到促进
B.a、d对应的纵坐标数值分别是:>10-12、>10-7
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com