
【题目】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是______________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案_____________________。
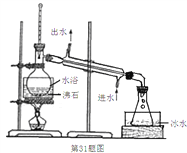
(3)蒸馏装置如下图所示,装置中存在的错误是_______________________________。
(4)滴定前,加入的适量溶液B是_________。
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为____________。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
【答案】分液 从溶液Ⅱ中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留 体系封闭;明火加热 B 0.576mol/L CD
【解析】
含Fe3+、Al3+试样X溶液25mL,加入适量浓盐酸和乙醚,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,当盐酸浓度降低时,该化合物解离,加入水解离后,通过蒸馏得到方法除去乙醚,得到含铁离子的水溶液,定容至100mL,取25.00mL溶液,滴入适量还原剂得到Fe2+离子的溶液,加入指示剂,滴定前,加入的适量溶液B为非氧离子化性和还原性的酸,用重铬酸钾溶液滴定至终点。
(1)操作A是利用在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,分离的名称为分液,故答案为:分液;
(2)依据铁离子遇到KSCN溶液变红色设计实验检验铁离子的存在,从溶液Ⅱ中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留,故答案为:从溶液Ⅱ中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留;
(3)蒸馏装置中锥形瓶不能密闭,否则蒸馏实验不能进行,乙醚是一种易挥发、易燃、有麻醉性的有机化合物,实验加热不能用明火,否则会引发燃烧导致危险,故答案为:体系密闭,明火加热;
(4)滴定需要的酸性环境,所需酸不能具有还原性、氧化性,不能被氧化剂氧化,也不能被亚铁离子还原。A.H2SO3-H3PO4 中亚硫酸具有还原性,也会被氧化剂氧化,消耗标准溶液增大,产生误差,故A错误;B.H2SO4-H3PO4 中酸为非氧化性酸,可以提供酸性环境且不影响测定反应,故B正确;C.HNO3-H3PO4 中硝 酸具有强氧化性,可以氧化亚铁离子,导致滴入氧化剂标准溶液减少,测定结果偏低,故C错误;D.HI-H3PO4 中HI酸是还原性酸,也可以消耗滴入的氧化剂,导致测定结果偏高,故D错误;故答案为:B;
(5)依据离子反应定量关系计算,定达到终点时,消耗0.1000 molL-1K2Cr2O7溶液6.00mL,物质的量=0.1000mol/L×0.00600L=0.00060mol,
反应为 Cr2O7 2-+6Fe2++H+=2Cr3++6Fe3++7H2O
1 6
0.00060mol 0.00360mol
c=![]() =0.144mol/L,则试样X中c(Fe3+)=0.144mol/L×
=0.144mol/L,则试样X中c(Fe3+)=0.144mol/L×![]() =0.576mol/L,故答案为:0.576mol/L;
=0.576mol/L,故答案为:0.576mol/L;
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可以重复几次实验,数值取平均值,减少误差,滴定溶液浓度越小,测定结果越准确。A.稀释被测试样,浓度减小,测定误差会增大,故A错误;B.减少被测试样取量,和滴定结果的精密度和准确度无关,故B错误;C.增加平行测定次数,减少测定带来的误差,可以提高准确度,故C正确;D.降低滴定剂浓度,反应终点判断更准确.滴定结果的精密度高,故D正确;故答案为:CD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )

A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是
![]()
A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1mol·L1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关.下列有关说法中不正确的是
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.腌制食品中应严格控制![]() 的用量
的用量
D.从海水中可提取Mg,用惰性电极电解熔融的![]() 或其水溶液都可制得Mg
或其水溶液都可制得Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制500mL浓度为![]() 溶液,需称取
溶液,需称取![]() 固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_____(填“大于”“小于”或“等于”,下同)![]() 。
。
(3)在实验(1)中,转移NaOH溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
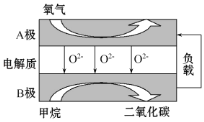
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;若外电路只通过了0.06mol电子,且阴极产生气体在标准状况下的体积为224mL,要使原溶液复原,可向电解后的溶液中加入____________。
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
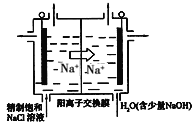
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式_________________________________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com