
【题目】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。
【答案】 -149 正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应  (平衡线与原平衡线相平) A Cu+Cl--e-===CuCl 6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O CuCl2+Cu
(平衡线与原平衡线相平) A Cu+Cl--e-===CuCl 6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O CuCl2+Cu![]() 2CuCl
2CuCl
【解析】(1) 根据表格数据可知,③H2(g)+ Cl2(g)= 2HCl(g) ΔH,3=(436 kJ·mol-1)+(243 kJ·mol-1)-(432 kJ·mol-1)×2=-185kJ·mol-1,①2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1,根据盖斯定律,将③-①得:H2(g)+2CuCl(s)
2CuCl(s) ΔH1=-36 kJ·mol-1,根据盖斯定律,将③-①得:H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2=ΔH,3-ΔH1=(-185kJ·mol-1)-(-36 kJ·mol-1)=-149 kJ·mol-1,故答案为:-149;
2Cu(s)+2HCl(g) ΔH2=ΔH,3-ΔH1=(-185kJ·mol-1)-(-36 kJ·mol-1)=-149 kJ·mol-1,故答案为:-149;
(2)反应②的正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应,因此制备活性铜的反应趋势大,故答案为:正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应;
(3) 在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),反应速率增大,平衡正向移动,但平衡常数不变,达到新平衡是氯气的浓度不变,Cl2浓度的变化趋势线为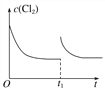 ,故答案为:
,故答案为: ;
;
(4)①阳极铜失去电子生成亚铜离子,生成的亚铜离子与氯离子结合生成白色不溶于水的CuCl,阳极区多余的钠离子向阴极区移动,因此装置中用的交换膜为阳离子交换膜,故选A;
②根据上述分析,阳极的电极反应式为Cu+Cl--e-=CuCl,故答案为:Cu+Cl--e-=CuCl;
(5)CuCl溶解于稀硝酸,发生氧化还原反应,反应的化学方程式为6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O,故答案为:6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O;
(6) CuCl中的铜为+1价,可以由铜离子与铜反应生成,反应的化学方程式为CuCl2+Cu![]() 2CuCl,故答案为:CuCl2+Cu
2CuCl,故答案为:CuCl2+Cu![]() 2CuCl。
2CuCl。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,取50 mL H+浓度为0.2 mol·L-1的盐酸和硫酸的混合溶液,加入50 mL Ba(OH)2溶液充分反应,得到沉淀0.233 g,反应后溶液中OH-浓度为0.01 mol·L-1(假设反应后溶液的总体积为100 mL)。
请计算:
(1)原混合酸溶液中H+的物质的量为__________ mol。
(2)加入的Ba(OH)2溶液的物质的量浓度为__________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )

A. 溶液中K+向电极b移动
B. 反应消耗的NH3与O2的物质的量之比为4:5
C. 氨气在电极a上发生氧化反应
D. 正极的电极反应式为:O2+4e﹣+2H20=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A. 双氧水和75%的酒精溶液都可以作消毒剂
B. 水玻璃可用于制备黏合剂和防火剂
C. 铁粉放在食品袋中作抗氧化剂
D. 明矾和蓝矾都可以作饮用水的净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香经A为原料合成某有机中间体M的路线如下:

己知:①RC1+R′C≡CNa→RC≡CR′+NaCl
②RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
请回答:
(1)A的质谱图如下图,A的结构简式为_______________。

(2)反应②的化学方程式为_______________________;反应①的反应类型为_______。
(3)D中最多有_____个原子共平面,E中含有的官能团名称为________。
(4)G的分子式为C5H8O2,其结构简式为_____;反应⑥中,除了生成M之外,还会生成一种M的同分异构体,其结构简式为_____________;
(5)同时满足下列条件的F同分异构体有________。
a.苯环上有3个取代基 b.l mol能与2 mol NaOH反应
(6)参照上述合成路线,以环氧乙烷为原料(无机试剂任选)设计制备聚乙二酸乙二酯的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入a mol H2和a mol Br2,在一定温度和压强下发生反应:
Br2(g)+ H2(g)![]() 2HBr(g)Δ< 0。当改变下列条件时,请填上相应变化。
2HBr(g)Δ< 0。当改变下列条件时,请填上相应变化。
(1)保持容器容积不变,向其中加入a mol He(He不参与反应),则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变”或“无法确定”)。平衡将____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(2)保持容器内气体压强不变,向其中加入a mol He(He不参与反应),则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变” 或“无法确定”)。平衡将____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(3)保持容器容积不变,向其中加入a mol H2,则该反应的正反应速率(V正)__________,逆反应速率(V逆)___________(填“增大”或“减小”或“不变”)。平衡____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(4)将容器体积压缩为原来一半,则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变” 或“无法确定”); 平衡____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”);容器内气体颜色_________填“变深”或“变浅”或“不变” 或“无法确定”);
(5)保持容器容积不变,将生成的HBr移走一部分,则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变”)。平衡将____________(填“向左移动”或“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在进行分液操作实验时需用到的玻璃仪器是烧杯和_______,在进行分液时,首先要对其进行________。
II、下图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。

(l)图中有两处明显的错误是:①__________;②___________。
(2)A仪器的名称是__________;B仪器的名称是__________。
(3)实验时A中除加入少量自来水外,还需要加入少量的_______,其作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸中都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氧气发生加成反应,苯不能与氢气加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com