
【题目】下列说法不正确的是
A.0.1mol·L1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
【答案】B
【解析】
A.常温下,0.1mol·L1NaOH溶液中c(OH-)=10-1mol·L1,c(H+)=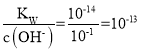 mol·L1,溶液的pH=13,升温到60℃,Kw增大,c(H+)=
mol·L1,溶液的pH=13,升温到60℃,Kw增大,c(H+)=![]() ,其pH变小,故A正确;
,其pH变小,故A正确;
B.等浓度的氨水加入稀盐酸至中性,溶液中c(H+)= c(OH-),溶液中存在电荷守恒:c(NH4+)+ c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-),NaOH溶液加入稀盐酸至中性,溶液中c(H+)= c(OH-),溶液中存在电荷守恒:c(Na +)+ c(H+)=c(OH-)+c(Cl-),则c(Na +)=c(Cl-),由于氨水是弱碱,当氨水与盐酸完全反应生成氯化铵时,溶液为酸性,要使溶液显中性,氨水消耗的盐酸比NaOH溶液消耗盐酸的量少,则c(NH4+)<c(Na+),故B错误;
C.氨水是弱碱,NaOH是强碱,等浓度的氨水、NaOH溶液,pH后者大,稀释相同的倍数,仍然pH后者大,故C正确;
D.等体积、等pH的氨水、NaOH溶液,氨水的浓度更大,氢氧根离子的总量比氢氧化钠溶液中的更多,氨水与铝离子反应生成氢氧化铝促进氨水继续电离氢氧根离子,且氨水与氢氧化铝沉淀不反应,氢氧化钠是强碱,完全电离,与铝离子反应过程中,氢氧根离子没有补充,则氨水与氯化铝反应生成氢氧化铝沉淀更多,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究二价铁的氧化反应,设计如下实验。
实验序号 | 试剂及操作 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,最终转变为红褐色 现象b:…… |
Ⅱ |
| 现象c:溶液略呈黄色 现象d:溶液呈红色 |
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是___________________________________。
(2)实验I中白色沉淀转变为红褐色的化学方程式是______。
(3)现象b是______。
(4)实验小组对实验II中何种物质氧化Fe2+进行研究,提出两种假设:
i.酸性条件下,O2氧化了Fe2+
ii.酸性条件下, _______
①将假设ii补充完整。
②设计实验,证实了假设i 不是实验II中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0 mL ______溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到______。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
(5)综合上述实验,说明二价铁的氧化反应与______因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的相对位置如表所示,其中X、Y、Z元素的原子最外层电子数之和为15。下列说法正确的是( )
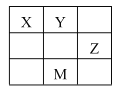
A.原子半径大小:Z>Y>X
B.简单氢化物沸点:X>Y
C.Z元素与X元素可形成直线形的共价化合物
D.M的原子序号为33,其最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的且符合操作要求的是
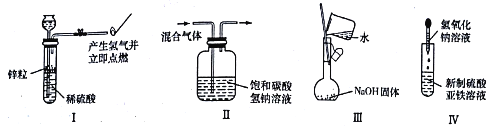
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是( )
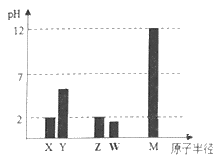
A.最简单气态氢化物的热稳定性:Z>W
B.Y的最高价氧化物的电子式为:![]()
C.W的气态氢化物是强酸
D.X、M两种元素形成的简单离子半径大小顺序:X>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
B.硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓
C.向FeBr2溶液中通入少量Cl2:Cl2 +2Br- = 2Cl-+ Br2
D.将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com