
【题目】下列离子方程式书写正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
B.硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓
C.向FeBr2溶液中通入少量Cl2:Cl2 +2Br- = 2Cl-+ Br2
D.将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
【答案】B
【解析】
A. HClO为弱酸,不能拆,所以氯气通入水中,离子方程式为:Cl2 + H2O ![]() H+ + Cl-+ HClO,故A错误;
H+ + Cl-+ HClO,故A错误;
B. H2SiO3为难溶性酸,所以硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓,故B正确;
C. 向FeBr2溶液中通入少量Cl2,Fe2+的还原性比Br-的强,所以先反应,离子方程式为:Cl2 +2Fe2+ = 2Cl-+ 2Fe3+ ,故C错误;
D. 磁性氧化铁化学式 为Fe3O4,溶于氢碘酸后产生Fe2+、Fe3+,而Fe3+具有强氧化性,能氧化I-,二者发生氧化还原反应的离子方程式为:2I- + Fe3O4 +8H+ = 3Fe2+ +4H2O+ I2,故D错误;
答案:B。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1mol·L1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3。利用废旧电池回收Zn、Mn化合物,对环境保护意义重大。
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液。
步骤二:处理固体,提取MnO2通过对获得的滤渣进行灼烧,灼烧的目的是__。灼烧时用到的实验仪器有酒精灯、玻璃棒、__。
步骤三:处理滤液,得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。有关的实验装置如图(夹持及加热装置略):
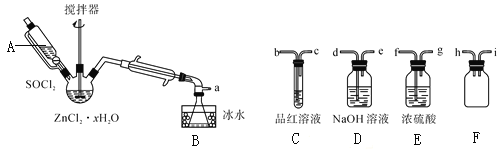
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃。140℃以上易分解,与水剧烈反应生成两种气体。
①仪器A的名称为__。
②蒸馏烧瓶中发生反应的化学方程式为:__。
③为回收剩余的SOCl2并验证生成物中含有SO2。上述仪器接目的连接响序为a→__。装置E中浓硫酸的作用___。
④为提高SOCl2的利用率,该实验宜采用的加热方式为__。
⑤讨论:将ZnCl2·xH2O晶体置于坩埚中加热均烧,__(能,不能)得到无水ZnCl2,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:_____________
互为同分异构体且属于芳香烃的分子的结构简式:_____________
(2)用系统命名法对下列有机物进行命名:
CH3C(CH3)=CHCH3:______________
CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________
(3)某烷烃A蒸气密度是相同状况下氢气密度的64倍,经测定知A分子中共含6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为____________;
②若A是炔烃与氢气加成的产物,A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2气体的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
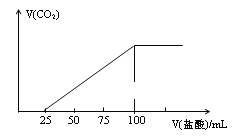
A.所得溶液溶质成分的物质的量之比为:n(NaHCO3):n(Na2CO3)=2: 1
B.所得溶液溶质成分的物质的量之比为:(NaOH):n(Na2CO3)=1: 3
C.原NaOH溶液的浓度为0.1mol/L
D.通入CO2体积为448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前含有元素硒![]() 的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是
的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是
A.原子序数为24B.最高价氧化物为SeO3,为酸性氧化物
C.原子半径比钙小D.气态氢化物分子式为H2Se,受热较容易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
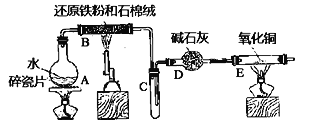
回答下列问题:
(1)装置B中发生反应的化学方程式是__________
(2)E中出现______________的现象。
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是__________
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:___________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择_______做氧化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com