
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
【答案】2Fe+3Cl2 ![]() 2FeCl3 含有Fe3+和Fe2+ 溶液呈红色 Fe3++3SCN-═Fe(SCN)3 a或b Fe3+或Fe3+和Fe2+ 还原性Fe2+>Cl-,逐滴加入的酸性KMnO4溶液,将Fe2+氧化,而使KMnO4紫色褪去,也可能是酸性KMnO4溶液将Cl-氧化,而使KMnO4紫色褪去
2FeCl3 含有Fe3+和Fe2+ 溶液呈红色 Fe3++3SCN-═Fe(SCN)3 a或b Fe3+或Fe3+和Fe2+ 还原性Fe2+>Cl-,逐滴加入的酸性KMnO4溶液,将Fe2+氧化,而使KMnO4紫色褪去,也可能是酸性KMnO4溶液将Cl-氧化,而使KMnO4紫色褪去
【解析】
(1)根据变价金属在氯气中燃烧生成高价的氯化物;
(2)A中可能含有两种金属阳离子;根据Fe3+遇KSCN溶液,溶液变红,Fe2+遇KSCN溶液,溶液不变红;
(3)根据Fe2+、Cl-都能被酸性KMnO4溶液氧化,但还原性:Fe2+>Cl-,逐滴加入的酸性KMnO4溶液,先将Fe2+氧化,而使KMnO4紫色褪去,故可能含有Fe2+;或加入的酸性KMnO4溶液,将Cl-氧化,而使KMnO4紫色褪去,据此分析解答(3)和(4).
(1)铁在氯气中燃烧生成氯化铁:2Fe+3Cl2 ![]() 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
(2)一定量的铁粉在氯气中充分燃烧后的固体中可能含有氯化铁和铁,将反应后的固体完全溶于稀盐酸,制得溶液A,A中可能含有Fe3+和Fe2+两种金属阳离子,Fe3+遇KSCN溶液,溶液变红,Fe2+遇KSCN溶液,溶液不变红,所以取少量溶液A于试管中,溶液呈红色,说明溶液中含Fe3+,则假设②不成立,假设①或③成立,离子方程式:Fe3++3SCN-═Fe(SCN)3,故答案为:含有Fe3+和Fe2+;溶液呈红色;Fe3++3SCN-═Fe(SCN)3;
(3)酸性KMnO4溶液可以氧化Fe2+、Cl-,使KMnO4紫色褪去,故溶液中可能含有Fe2+;加入的酸性KMnO4溶液也可能是被Cl-还原的,使KMnO4紫色褪去,即也可能不含Fe2+,故答案为:a或b;
(4)因为还原性Fe2+>Cl-,逐滴加入的酸性KMnO4溶液将Fe2+氧化,而使KMnO4紫色褪去,也可能是酸性KMnO4溶液被Cl-还原,而使KMnO4紫色褪去,因此A中含有的阳离子是Fe3+或Fe3+和Fe2+,故答案为:Fe3+或Fe3+和Fe2+;还原性Fe2+>Cl-,逐滴加入的酸性KMnO4溶液,将Fe2+氧化,而使KMnO4紫色褪去,也可能是酸性KMnO4溶液将Cl-氧化,而使KMnO4紫色褪去。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】中科院一项新研究成果实现了甲烷高效生产乙烯,其反应为:2CH4(g)![]() C2H4(g)+2H2(g) ΔH>0
C2H4(g)+2H2(g) ΔH>0
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如表,完成热化学方程式:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=__。
C2H4(g)+2H2(g) ΔH=__。
(2)温度为T1℃时,向1 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应0~15 min CH4的物质的量随时间变化如图1,实验测得10~15 min时H2的浓度为1.6 mol/L。

①若图1中曲线a、b分别表示在T1℃时,使用等质量的两种不同的催化剂时,达到平衡过程中n(CH4)变化曲线,判断:催化剂a_____b(填“优于”或“劣于”)。
②在15 min时改变反应条件,导致n(CH4)发生变化(见图1),则改变的条件可能是:_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数仅与温度有关,温度为![]() 时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
(4)科研人员设计了甲烷燃料电池并用于电解(如图2)。电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
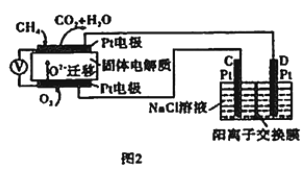
①图中C处的Pt为_______(填“阴”或“阳”)极。
②该电池工作时负极的电极反应式为________。
③用该电池电解饱和食盐水,一段时间后收集到标准状况下气体总体积为112 mL,则阴极区所得溶液在25℃时pH=_______(假设电解前后NaCl溶液的体积均为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
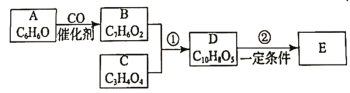
【题目】有机化合物E(![]() )是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
)是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
已知:
①R1CHO+R2CH2COOH![]() R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
③CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl
ClCH2CH=CH2+HCl
回答下列问题:
(1)有机物A的名称为________。1 mol有机物C与足量![]() 反应,能产生标准状下44.8 L
反应,能产生标准状下44.8 L ![]() ,写出C的结构简式:__________。
,写出C的结构简式:__________。
(2)有机物B中含有的官能团的名称为____________。比B多一个“![]() ”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
(3)有机物D能发生的化学反应有_________(填写选项字母)。
A.加成反应 B.水解反应 C.氧化反应 D.消去反应
(4)写出反应①的化学方程式:__________________________
(5)根据题目信息,以丙烯为原料(其他无机试剂任选),设计制备化合物C的合成路线:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。
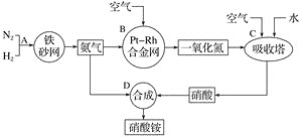
(1)写出反应容器B中发生反应的化学方程式:____。
(2)吸收塔C中通入空气的目的是___;C、D两个反应容器中发生的反应,属于氧化还原反应的是___(填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是_____。
(5)将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
①写出上述过程中,有关反应的离子方程式:____、____。
②完成该反应至少需要量取10mol·L-1的浓硝酸_____mL。
③混合气体中NO2的体积为____L,NO的体积为____L(均为标准状况下)。
④将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E 元素的周期序数与主族序数相等。
(1)E 元素在周期表中的位置___________。
(2)写出A2W2的电子式为____________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是_________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___(填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为____。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___,石墨烯导电的原因是____。

(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
物质 | 六氯苯
| 六溴苯
| 苯六酸
|
熔点/℃ | 231 | 325 | 287 |
水溶性 | 不溶 | 不溶 | 易溶 |
六溴苯的熔点比六氯苯高的原因是____,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___。
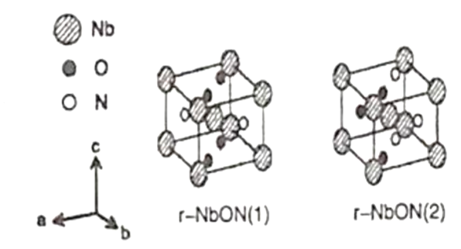
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
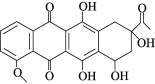
A.每个柔红酮分子中含有2个手性碳原子
B.一定条件下柔红酮可发生消去、氧化、加成、取代反应
C.1 mol柔红酮最多可与2 mol Br2发生取代反应
D.柔红酮分子中所有的碳原子有可能都在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1mol·L1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com