
【题目】据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___(填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为____。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___,石墨烯导电的原因是____。

(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
物质 | 六氯苯
| 六溴苯
| 苯六酸
|
熔点/℃ | 231 | 325 | 287 |
水溶性 | 不溶 | 不溶 | 易溶 |
六溴苯的熔点比六氯苯高的原因是____,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___。
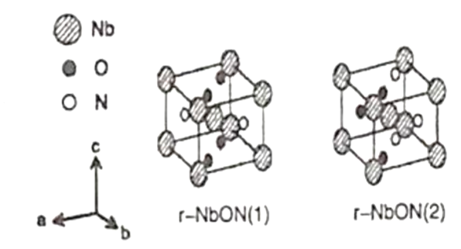
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93)
【答案】a 四面体形 sp3 石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性 两者结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高 苯六酸含多个羧基,与水分子形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,难溶于水 ![]()
【解析】
(1)激发态失去最外层1个电子所需能量最小;
(2)As原子与2个C原子、1个Cl原子形成共价键,还有一对孤电子对;
(3)石墨烷中碳原子形成4个共价键,杂化类型为sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性;
(4)分子晶体,结构相似,相对分子质量越大,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子能形成氢键;六氯苯、六溴苯为非极性分子,根据相似相溶原理,均难溶于水;
(5)根据![]() 计算。
计算。
(1)Nb元素的基态原子的核外电子排布式为[Kr]4d55s1,失去最外层1个电子所需能量, [Kr]4d35s15p1属于激发态的电子排布式,所以失去最外层1个电子所需能量最小的a,故答案为:a;
(2)As原子与2个C原子、1个Cl原子形成共价键,还有一对孤电子对,其VSEPR模型为四面体形,故答案为:四面体形;
(3)石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子形成4个共价键,杂化类型为sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性,故答案为:sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性;
(4)六溴苯和六氯苯均属于分子晶体,且结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子能形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,根据相似相溶原理,均难溶于水,故答案为:两者结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,难溶于水;
(5)根据晶胞图可知,该晶胞中含有2个Nb原子,2个O原子,2个N原子,所以![]() ,故答案为:
,故答案为:![]() ;
;


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】苯乙烯是中学化学常见的一种有机物,结构简式如图所示,以下说法正确的是( )

A.1 mol该物质与溴水充分反应,消耗4mol![]()
B.该分子中最多有16个原子共平面
C.该分子中最多有7个C原子共平面
D.该分子中最多有4个C原子共直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃催化裂解是制备短链烯烃的重要途径。研究表明,1-丁烯[CH3CH2CH=CH2(g)]催化裂解时,发生两个平行竞争反应生成丙烯和乙烯,两反应的热化学方程式为:
①3CH3CH2CH=CH2(g)![]() 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1
②CH3CH2CH=CH2(g)![]() 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1
回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为____;1-丁烯转化为丙烯反应的化学平衡常数表达式为_____。
(2)有利于提高1-丁烯平衡转化率的措施有_______。
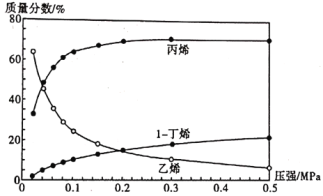
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是______。
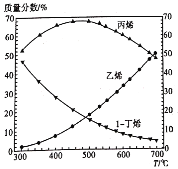
(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是_____。0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线如下图所示。由图可知,生产过程中提高丙烯质量分数的最佳温度为___℃,在该温度之前各温度对应的组成______(填“一定是”、“可能是”或“一定不是”)平衡态,理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从甜橙的芳香油中可分离得到如图结构的化合物,
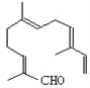
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能与该化合物中所有官能团都发生反应的试剂有( )
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法中,不正确的是
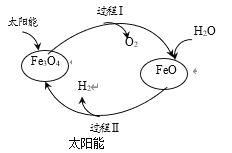
A.过程Ⅰ的反应:2Fe3O4= 6FeO+O2↑
B.过程Ⅱ的反应:2H2O =2H2↑+O2↑
C.两个转化过程都发生了氧化还原反应
D.整个过程实现了太阳能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究二价铁的氧化反应,设计如下实验。
实验序号 | 试剂及操作 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,最终转变为红褐色 现象b:…… |
Ⅱ |
| 现象c:溶液略呈黄色 现象d:溶液呈红色 |
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是___________________________________。
(2)实验I中白色沉淀转变为红褐色的化学方程式是______。
(3)现象b是______。
(4)实验小组对实验II中何种物质氧化Fe2+进行研究,提出两种假设:
i.酸性条件下,O2氧化了Fe2+
ii.酸性条件下, _______
①将假设ii补充完整。
②设计实验,证实了假设i 不是实验II中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0 mL ______溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到______。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
(5)综合上述实验,说明二价铁的氧化反应与______因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是( )
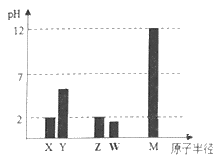
A.最简单气态氢化物的热稳定性:Z>W
B.Y的最高价氧化物的电子式为:![]()
C.W的气态氢化物是强酸
D.X、M两种元素形成的简单离子半径大小顺序:X>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com