
【题目】(1)配制500mL浓度为![]() 溶液,需称取
溶液,需称取![]() 固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_____(填“大于”“小于”或“等于”,下同)![]() 。
。
(3)在实验(1)中,转移NaOH溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度______![]() 。
。
【答案】4.0 冷却至室温 ![]() 容量瓶 大于 小于
容量瓶 大于 小于
【解析】
(1)依据m=cVM计算需要溶质的质量;配制一定物质的量浓度溶液应在容量瓶中进行,注意容量瓶规格选择,注意容量瓶应在室温时体积才准确;
(2)(3)分析操作对溶质物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(1)配制500mL浓度为0.2molL-1NaOH溶液,应选择500mL容量瓶;需要溶质的质量为:0.5L×0.2mol/L×40g/mol=4.0g;准确称量氢氧化钠以后,应先在烧杯中溶解,冷却到室温后,移液到500mL容量瓶;
答案为:4.0;冷却到室温;500mL容量瓶;
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,导致溶液体积偏小,会导致所配制的溶液中溶质的物质的量浓度大于0.2 molL-1;
答案为:大于;
(3)在实验(1)中,转移NaOH溶液至容量瓶中时洒落少许,导致部分溶质损耗,溶质物质的量偏小,则所配制的溶液中溶质的物质的量浓度小于0.2 molL-1;
故答案为:小于。


科目:高中化学 来源: 题型:
【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
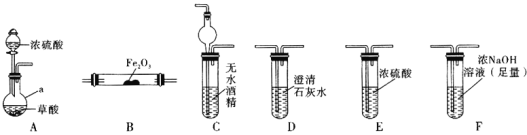
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
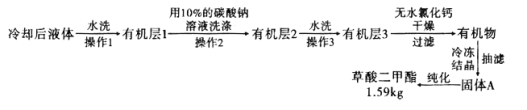
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | —— | —— |
(1)用![]() 还原无水
还原无水![]() 制取
制取![]() 。有关装置如图1所示:
。有关装置如图1所示:
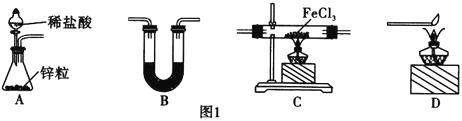
![]() 还原无水
还原无水![]() 制取
制取![]() 的化学方程式为________________________。
的化学方程式为________________________。
![]() 中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________
中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________![]() 填母,装置可多次使用
填母,装置可多次使用![]() 。
。
![]() 该制备装置的缺点为________________________________。
该制备装置的缺点为________________________________。
(2)利用反应![]() ,制取无水
,制取无水![]() 并测定
并测定![]() 的转化率。按图2装置,在三颈烧瓶中放入
的转化率。按图2装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

![]() 仪器a的作用是________________________。
仪器a的作用是________________________。
![]() 反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________
反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________![]() 填名称
填名称![]() ,回收滤液中
,回收滤液中![]() 的操作方法是________。
的操作方法是________。
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是________________,在反应完成后继续通一段时间
的目的是________________,在反应完成后继续通一段时间![]() 的作用是________________________________。
的作用是________________________________。
![]() 反应后将锥形瓶中溶液配成250mL,量取
反应后将锥形瓶中溶液配成250mL,量取![]() 所配溶液,用
所配溶液,用![]() 溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为
溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为![]() 、
、![]() 、
、![]() ,则氯化铁的转化率为________________。
,则氯化铁的转化率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地诉说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式________________________________。
(2)下列说法正确的是________。
a.H2S、O3分子都是直线形
b.BF3和NH3均为三角锥形
c.CO2、HCN分子的结构式分别是O=C=O、H—C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
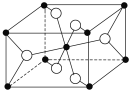
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图, 白球表示________原子。
(4)乙酸(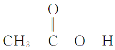 )熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
)熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是______________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案_____________________。
(3)蒸馏装置如下图所示,装置中存在的错误是_______________________________。
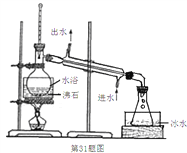
(4)滴定前,加入的适量溶液B是_________。
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为____________。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:[C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
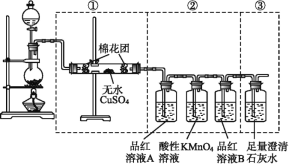
(1)②中酸性KMnO4溶液的作用是____________。
(2)②中两次用到品红溶液,它们的作用分别是A______,B_____。
(3)③中出现的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是
A.洪涝、地震灾区灾后可用石灰消毒,是利用石灰可使蛋白质发生变性的性质
B.食品添加剂对人体均有益,可随意使用
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.![]() 是指大气中直径小于或等于
是指大气中直径小于或等于![]() 微米的颗粒物,也称为可入肺颗粒物,分散在空气中可能形成胶体
微米的颗粒物,也称为可入肺颗粒物,分散在空气中可能形成胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.l mol ·L1的H2SO4溶液:NH4+、Fe2+、Cl、NO3-
B.0.l mol ·L1的FeCl3溶液:K+、Al3+、SO42-、NO3-
C.0.l mol ·L1的Na2SO3溶液:Ba2+、K+、ClO-、MnO4-
D.0.l mol ·L1的Ba(OH)2溶液:Mg2+、Na+、HCO3-、Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com