
【题目】![]() 是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | —— | —— |
(1)用![]() 还原无水
还原无水![]() 制取
制取![]() 。有关装置如图1所示:
。有关装置如图1所示:
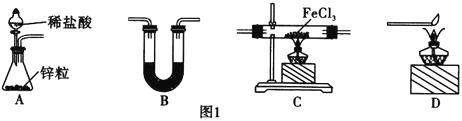
![]() 还原无水
还原无水![]() 制取
制取![]() 的化学方程式为________________________。
的化学方程式为________________________。
![]() 中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________
中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________![]() 填母,装置可多次使用
填母,装置可多次使用![]() 。
。
![]() 该制备装置的缺点为________________________________。
该制备装置的缺点为________________________________。
(2)利用反应![]() ,制取无水
,制取无水![]() 并测定
并测定![]() 的转化率。按图2装置,在三颈烧瓶中放入
的转化率。按图2装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

![]() 仪器a的作用是________________________。
仪器a的作用是________________________。
![]() 反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________
反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________![]() 填名称
填名称![]() ,回收滤液中
,回收滤液中![]() 的操作方法是________。
的操作方法是________。
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是________________,在反应完成后继续通一段时间
的目的是________________,在反应完成后继续通一段时间![]() 的作用是________________________________。
的作用是________________________________。
![]() 反应后将锥形瓶中溶液配成250mL,量取
反应后将锥形瓶中溶液配成250mL,量取![]() 所配溶液,用
所配溶液,用![]() 溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为
溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为![]() 、
、![]() 、
、![]() ,则氯化铁的转化率为________________。
,则氯化铁的转化率为________________。
【答案】![]()
![]()
![]() 碱石灰 ABCBD
碱石灰 ABCBD ![]() 、
、![]() 易升华,蒸气遇冷凝华易堵塞导管 冷凝回流 苯 蒸馏 排尽装置中的空气,以防止
易升华,蒸气遇冷凝华易堵塞导管 冷凝回流 苯 蒸馏 排尽装置中的空气,以防止![]() 被氧化 将反应生成的HCl全部排入装置B中
被氧化 将反应生成的HCl全部排入装置B中 ![]()
【解析】
![]() 与无水
与无水![]() 反应生成
反应生成![]() 和氯化氢;
和氯化氢;
![]() 用A装置制备的氢气含有水蒸气,用B装置干燥气体;干燥后的氢气与无水
用A装置制备的氢气含有水蒸气,用B装置干燥气体;干燥后的氢气与无水![]() 在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气;
在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气;
![]() 根据氯化铁、氯化亚铁易升华分析;
根据氯化铁、氯化亚铁易升华分析;
![]() 根据装置图回答仪器B的名称;
根据装置图回答仪器B的名称;
![]() 根据氯苯和副产物
根据氯苯和副产物![]() 溶于苯,
溶于苯,![]() 不溶于苯选择洗涤剂;根据氯苯和
不溶于苯选择洗涤剂;根据氯苯和![]() 的沸点不同分离苯和
的沸点不同分离苯和![]() 的混合物;
的混合物;
![]() 根据氯化亚铁易被氧气氧化分析反应前需向A中通入N
根据氯化亚铁易被氧气氧化分析反应前需向A中通入N![]() 的目的;该实验根据生成氯化氢的物质的量计算
的目的;该实验根据生成氯化氢的物质的量计算![]() 的转化率,在反应完成后继续通一段时间
的转化率,在反应完成后继续通一段时间![]() 的作用是避免反应产生的HCl气体会在容器内滞留;
的作用是避免反应产生的HCl气体会在容器内滞留;
![]() ;
;
![]() 还原无水
还原无水![]() 制取
制取![]() 的反应为:
的反应为:![]()
![]()
![]() ;
;
![]() 用A装置制备氢气,用B装置干燥气体,干燥后的氢气与无水
用A装置制备氢气,用B装置干燥气体,干燥后的氢气与无水![]() 在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,故连接顺序为: ABCBD;B的目的是干燥吸水,盛放的试剂是碱石灰;
在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,故连接顺序为: ABCBD;B的目的是干燥吸水,盛放的试剂是碱石灰;
![]() 氯化铁、氯化亚铁易升华,故该制备装置可能会因为
氯化铁、氯化亚铁易升华,故该制备装置可能会因为![]() 、
、![]() 易升华,蒸气遇冷凝华易堵塞导管;
易升华,蒸气遇冷凝华易堵塞导管;
![]() 仪器a为球形冷凝管,其作用为冷凝回流;
仪器a为球形冷凝管,其作用为冷凝回流;
![]() 反应结束后,三颈烧瓶内的物质主要是产物
反应结束后,三颈烧瓶内的物质主要是产物![]() ,还有多余的氯苯和副产物
,还有多余的氯苯和副产物![]() ,由题可知,氯苯和副产物
,由题可知,氯苯和副产物![]() 溶于苯,
溶于苯,![]() 不溶于苯,故洗涤所用的试剂可以是苯,以减少产品的损失;滤液的溶质有氯苯和
不溶于苯,故洗涤所用的试剂可以是苯,以减少产品的损失;滤液的溶质有氯苯和![]() ,由表可知,二者沸点相差较大,可用蒸馏的方法分离,故回收滤液中
,由表可知,二者沸点相差较大,可用蒸馏的方法分离,故回收滤液中![]() 的操作方法是蒸馏滤液,并收集沸点
的操作方法是蒸馏滤液,并收集沸点![]() 的馏分;
的馏分;
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是排尽装置中的空气,以防止
的目的是排尽装置中的空气,以防止![]() 被氧化;该实验根据生成氯化氢的物质的量计算
被氧化;该实验根据生成氯化氢的物质的量计算![]() 的转化率,在反应完成后继续通一段时间
的转化率,在反应完成后继续通一段时间![]() 的作用是避免反应产生的HCl气体会在容器内滞留,将反应生成的HCl全部排入装置B中;
的作用是避免反应产生的HCl气体会在容器内滞留,将反应生成的HCl全部排入装置B中;
![]() 无水氯化铁理论上生成的
无水氯化铁理论上生成的![]() ,
,![]() 误差较大,舍去,则消耗NaOH溶液的体积平均值为
误差较大,舍去,则消耗NaOH溶液的体积平均值为![]() ,HCl消耗标准液NaOH为
,HCl消耗标准液NaOH为![]() ,故反应生成的
,故反应生成的![]() ,故氯化铁的转化率为
,故氯化铁的转化率为![]() ;
;


科目:高中化学 来源: 题型:
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___。
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
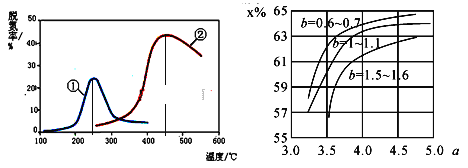
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______。
②以下说法正确的是_________。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
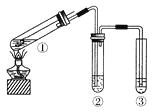
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
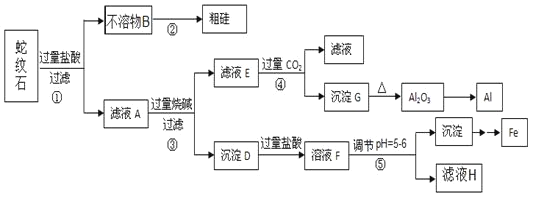
【题目】蛇纹石矿可以看作由MgO、![]() 、
、![]() 和
和![]() 组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| 1.9 | 3.2 |
| 9.4 | 11.6 |
(1)蛇纹石中所含的氧、镁、硫、铝这几种元素的简单离子的半径由小到大的顺序_____,滤液A中含有的阳离子有 _________。
(2)硅元素在周期表中的位置______,二氧化碳的电子式___________。
(3)操作②中反应的化学方程式为 ____,操作④中生成沉淀G的离子方程式为 _____。
(4)操作⑤中调节pH到![]() 时,可以用到的试剂
时,可以用到的试剂![]() 填序号
填序号![]() ____________。
____________。
a、NaOH b、氨水 c、MgO d、Mg(OH)2
(5)从滤液H制取金属Mg的流程如下:
![]()
流程中冶炼镁的方法是__________,在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是
![]()
A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效、新型的水处理剂,在碱性条件下较稳定;在中性或弱酸性条件下转化为Fe(OH)3和O2;易被H2还原。工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备Na2FeO4并回收某些金属资源的工艺流程如图:
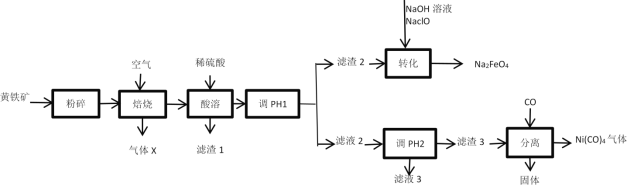
已知:
Ⅰ.“焙烧”后矿石中的金属元素均以氧化物的形式存在。
Ⅱ.溶液中离子浓度小于1×10-5mol/L时,该离子沉淀完全。
(1)“粉碎”的目的是___。
(2)气体X为__,滤渣1为__。
(3)流程中“调节pH1”的实验操作目的是___。
(4)“转化”过程中发生的主要反应的离子方程式为___。
(5)采用电解法制备Na2FeO4的工作原理如图所示:
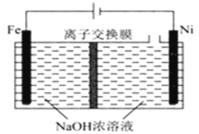
①该装置工作时,阳极的电极反应式为___。
②离子交换膜应选用___(填“阴”或“阳”)离子交换膜,原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1mol·L1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制500mL浓度为![]() 溶液,需称取
溶液,需称取![]() 固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
固体____g,然后再加入适量水,将上述固体溶解,待__________后,再转移到______中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_____(填“大于”“小于”或“等于”,下同)![]() 。
。
(3)在实验(1)中,转移NaOH溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.小苏打溶液中滴入氢氧化钠溶液:HCO3—+OH—= H2O+CO2↑
B.电解饱和食盐水:2Cl-+ 2H+ ![]() H2↑+ Cl2↑
H2↑+ Cl2↑
C.三氯化铁溶液中滴入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ + 2H+ + H2O2=Fe3+ + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com