
【题目】高铁酸钠(Na2FeO4)是一种高效、新型的水处理剂,在碱性条件下较稳定;在中性或弱酸性条件下转化为Fe(OH)3和O2;易被H2还原。工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备Na2FeO4并回收某些金属资源的工艺流程如图:
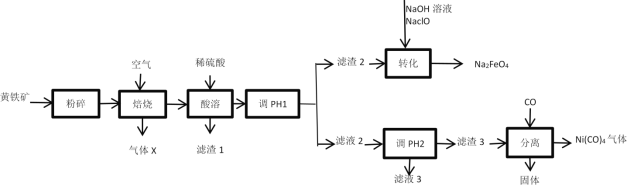
已知:
Ⅰ.“焙烧”后矿石中的金属元素均以氧化物的形式存在。
Ⅱ.溶液中离子浓度小于1×10-5mol/L时,该离子沉淀完全。
(1)“粉碎”的目的是___。
(2)气体X为__,滤渣1为__。
(3)流程中“调节pH1”的实验操作目的是___。
(4)“转化”过程中发生的主要反应的离子方程式为___。
(5)采用电解法制备Na2FeO4的工作原理如图所示:
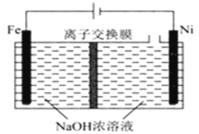
①该装置工作时,阳极的电极反应式为___。
②离子交换膜应选用___(填“阴”或“阳”)离子交换膜,原因____。
【答案】加快“焙烧”速率,使“焙烧”更充分 X为SO2 滤渣1为SiO2 “调节pH1”目的是使Fe3+转化为Fe(OH)3沉淀而Cu2+和Ni2+不沉淀 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O Fe+8OH--6e-=FeO42-+4H2O 阳 可防止FeO42-进入阴极区被H2还原
【解析】
黄铁矿粉碎,增大与空气的接触面积,可加快化学反应速率,是焙烧更加充分。充分焙烧后,得各金属的氧化物以及SiO2,矿石中的硫元素转化为SO2,加入稀硫酸酸化,SiO2不与硫酸反应过滤除去,而金属氧化物与硫酸反应得到硫酸盐,调节pH1,在滤渣2中得到Fe(OH)3,Fe(OH)3、NaClO、NaOH反应得到Na2FeO4。滤液2中有Cu2+和Ni2+;调节pH2,分离Ni和Cu;Ni(OH)2最终转化为Ni(CO)4。
(1)黄铁矿粉碎,可以增大固体的表面积,加快“焙烧速率”,使“焙烧”更充分;
(2)根据元素守恒,黄铁矿焙烧时,金属元素均转化为其氧化物,因此气体X为SO2;金属氧化物均与硫酸反应转化为可溶于水的硫酸盐,而SiO2不与硫酸反应,因此滤渣1为SiO2;
(3)根据流程图,滤渣2最终转化为Na2FeO4,因此滤渣2为Fe(OH)3,调节pH1的目的是使Fe3+转化为Fe(OH)3,与Cu2+、Ni2+分离;
(4)转化过程,Fe(OH)3、NaOH和NaClO转化为Na2FeO4,Fe的化合价从+3价升高到+6价,Cl的化合价从+1价降低到-1价,化合价升降守恒,Fe(OH)3和ClO-的系数为2:3,再根据质量守恒和电荷守恒配平,离子方程式为2Fe(OH)3+3ClO-+4OH-=FeO42-+3Cl-+5H2O;
(5)采用电解制备Na2FeO4,示意图中,Fe作阳极,失去电子,转化为FeO42-,阴极为水得到电子,生成H2和OH-;
①Fe作阳极,失去电子,转化为FeO42-,电极方程式为Fe+8OH--6e-=FeO42-+4H2O;
②Na2FeO4容易被H2还原,因此要需要防止阴极生成的H2还原FeO42-,离子交换膜应选择阳离子交换膜,可防止FeO42-进入阴极区被H2还原。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g) ![]() CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:

下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L1·min1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
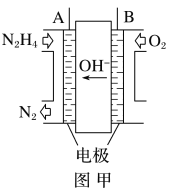
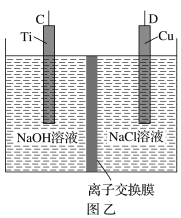
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________,
肼燃料电池中A极发生的电极反应为____________________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | —— | —— |
(1)用![]() 还原无水
还原无水![]() 制取
制取![]() 。有关装置如图1所示:
。有关装置如图1所示:
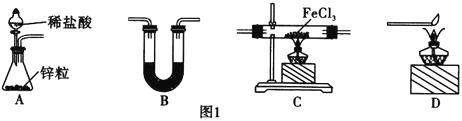
![]() 还原无水
还原无水![]() 制取
制取![]() 的化学方程式为________________________。
的化学方程式为________________________。
![]() 中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________
中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________![]() 填母,装置可多次使用
填母,装置可多次使用![]() 。
。
![]() 该制备装置的缺点为________________________________。
该制备装置的缺点为________________________________。
(2)利用反应![]() ,制取无水
,制取无水![]() 并测定
并测定![]() 的转化率。按图2装置,在三颈烧瓶中放入
的转化率。按图2装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

![]() 仪器a的作用是________________________。
仪器a的作用是________________________。
![]() 反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________
反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________![]() 填名称
填名称![]() ,回收滤液中
,回收滤液中![]() 的操作方法是________。
的操作方法是________。
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是________________,在反应完成后继续通一段时间
的目的是________________,在反应完成后继续通一段时间![]() 的作用是________________________________。
的作用是________________________________。
![]() 反应后将锥形瓶中溶液配成250mL,量取
反应后将锥形瓶中溶液配成250mL,量取![]() 所配溶液,用
所配溶液,用![]() 溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为
溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为![]() 、
、![]() 、
、![]() ,则氯化铁的转化率为________________。
,则氯化铁的转化率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将两块未擦去氧化膜的铝片分别投入1mol·L-1CuSO4溶液和1mol·L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象
B.溶液酸碱性对H2O2的稳定性有较大影响,在酸性溶液中,H2O2分解较快
C.Fe3+能与硫氰化钾反应生成可溶于水的血红色配合物
D.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地诉说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式________________________________。
(2)下列说法正确的是________。
a.H2S、O3分子都是直线形
b.BF3和NH3均为三角锥形
c.CO2、HCN分子的结构式分别是O=C=O、H—C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
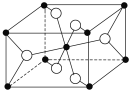
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图, 白球表示________原子。
(4)乙酸(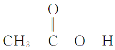 )熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
)熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:[C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
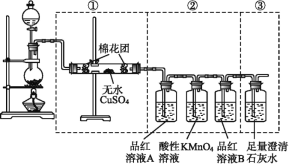
(1)②中酸性KMnO4溶液的作用是____________。
(2)②中两次用到品红溶液,它们的作用分别是A______,B_____。
(3)③中出现的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.合成氨工业用铁触媒作催化剂
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com