

| A、A | B、B | C、C | D、D |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1mol OH-含有的电子数目为9NA | ||
| B、1mol Cl2和氢氧化钠完全反应,转移的电子数目为NA | ||
| C、室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | ||
D、1mol
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、14+
| ||||
D、14+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应在常温下都能自发进行 |
| B、Fe3++3H2O?Fe(OH)3+3H+是吸热反应 |
| C、熵值大小关系为:S(冰)>S(水)>S(水蒸气) |
| D、对C(s)+H2O(g)?CO(g)+H2(g),多加些炭可以提高化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据对角线规则,铍和铝的性质具有相似性 |
| B、[Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键 |
| C、元素电负性越大的原子,吸引电子的能力越强 |
| D、手性分子互为镜像,它们的性质没有区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和水的反应:Na+H2O=Na++OH-+H2↑ |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-=BaSO↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯原子的结构示意图: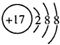 | ||
B、CO2分子的比例模型: | ||
C、具有10个中子的氧原子:
| ||
| D、乙烯的结构简式:C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
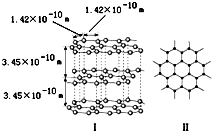 (1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成
(1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | X | Y | Z |
| 所含元素种数 | 1 | 2 | 3 |
| 分子中的电子总数 | 大于10 | 18 | |
| 燃烧热(kJ/mol) | -285.8 | -283 | -726.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com