
 如图:纵坐标表示可燃气体A、B、C(C是A和B的混合物)的体积,横坐标表示A、B、C在完全燃烧时,消耗O2的体积,测混合气体C中A和B的体积比为( )
如图:纵坐标表示可燃气体A、B、C(C是A和B的混合物)的体积,横坐标表示A、B、C在完全燃烧时,消耗O2的体积,测混合气体C中A和B的体积比为( )| A、VA:VB=1:1 |
| B、VA:VB=1:2 |
| C、VA:VB=2:1 |
| D、VA:VB为任意比 |


科目:高中化学 来源: 题型:
| A、该分散系能产生丁达尔效应 |
| B、该分散质颗粒能透过滤纸 |
| C、该分散质颗粒能透过半透膜 |
| D、该分散质颗粒能发生布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英溶于氢氧化钠溶液:SiO2+2OH-═SiO32-+H2O |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| C、铁粉与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ |
| D、金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
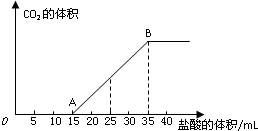 将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:
将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验. | 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com