
分析 (1)3.86 克沉淀是Ag2CO3和Ag2S 的混和物,加入醋酸发生反应:Ag2CO3+2CH3COOH=2CH3COOAg+H2O+CO2↑,剩余固体2.48g为Ag2S的质量,再计算Ag2CO3的质量,根据n=$\frac{m}{M}$计算各自物质的量,根据守恒计算Na2CO3 和Na2S 的物质的量,再根据c=$\frac{n}{V}$计算物质的量浓度;
(2)根据方程式计算生成二氧化碳的物质的量,再根据V=nVm计算其体积.
解答 解:(1)3.86 克沉淀是Ag2CO3和Ag2S 的混和物,加入醋酸发生反应:Ag2CO3+2CH3COOH=2CH3COOAg+H2O+CO2↑,剩余固体2.48g为Ag2S的质量,
n(Na2S)=n(Ag2S)=$\frac{2.48g}{248g/mol}$=0.01mol,c(Na2S)=$\frac{0.01mol}{0.05L}$=0.2mol/L,
n(Na2CO3)=n(Ag2CO3)=$\frac{3.86g-2.48g}{276g/mol}$=0.005mol,c(Na2CO3)=$\frac{0.005mol}{0.05L}$=0.1mol/L,
故答案为:0.1;0.2;
(2)Ag2CO3+2CH3COOH=2CH3COOAg+H2O+CO2↑
0.005mol 0.005mol
故生成二氧化碳的体积为:0.005mol×22.4L/mol=0.112L,
故答案为:0.112.
点评 本题考查混合物计算、化学方程式计算,侧重考查物质的量有关计算,关键是明确发生的反应,难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤ | C. | ③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
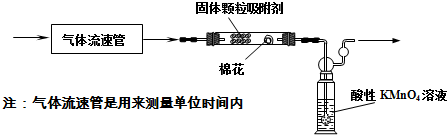
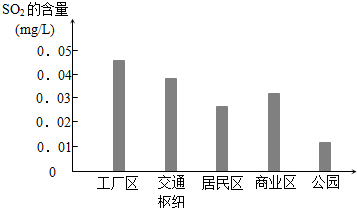
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、SO42- | B. | Cu2+、SO42-、NO3- | C. | Na+、K+、Cl- | D. | MnO4-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与稀硝酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁腐蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
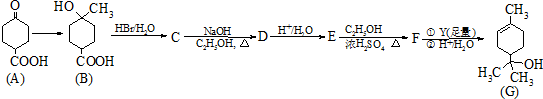
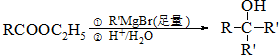
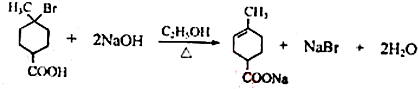 .
.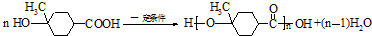 .
.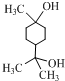 .
.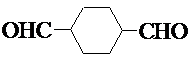 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com