
下列说法正确的是 ( )
A.石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化
B.红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品
C.光导纤维、醋酸纤维、铜氨纤维、玻璃纤维等的主要成分都是糖类
D.PM2.5是指大气中直径小于或等于2.5纳米的颗粒物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H=﹣43kJ•mol﹣1对于上述反应,下列措施中能提高CO转化率的是( )
|
| A. | 增大压强 | B. | 升高温度 |
|
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,在定压容器a与定容容器b中,分别通入等量且体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率是( )
|
| A. | a大 | B. | b大 | C. | a、b一样大 | D. | 不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要意义.
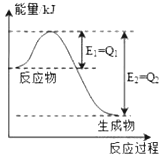
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式: N2(g)+3H2(g)⇌2NH3(g)△H=﹣2(Q2﹣Q1)kJ•mol﹣1 (△H的数值用含字母Q1、Q2的代数式表示).
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的体积分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题,

①2SO3⇌2SO2+O2的△H < 0.
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 > K2;
③反应进行到状态D时,v正 > v逆(填<、>或=).
(3)Cl2合成有机物时会产生副产物HC1.4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)可实现氯的循环利用.
①该反应平衡常数的表达式K= 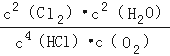 ;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
②若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 b .
a.4v正(HCl)=v逆(O2)
b.又加入1mol O2,达新平衡时,HCl的转化率增大
c.分离出H2O,达新平衡时,v正(HCl)增大
③图2是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1下,反应温度对HCl平衡转化率影响的曲线.下列叙述正确的是 c .
a.其他条件不变,升高温度,平衡常数K值增大
b.若平衡常数K值变大,达新平衡前v逆始终减小
c.若平衡常数K值变大,则平衡向正反应方向移动
④投料比为4:1、温度为400℃时,平衡混合物中
Cl2的物质的量分数是 35.3 %.(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及离子方程式书写的评价合理的是 ( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是
( )
A.溶液中c(Na+)=2c(SO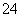 )
)
B.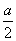 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=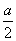 mol
mol
D.原浓硫酸中H2SO4的物质的量>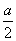 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:( )
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
A.放电时负极反应为:3Zn —6e—+6OH— == 3Zn(OH)2
B.放电时OH—向正极移动
C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原
D.充电时阳极反应式为:3Zn(OH)2+6e— == 3Zn+6OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度为0.01 mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
A.0.05mol/L B.0.001mol/L C.0.002mol/L D.0.005mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com