
【题目】白磷与氧气可发生反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为 E(P—P)=a kJ·mol-1、E(P—O)=b kJ·mol-1、E(P=O)=c kJ·mol-1、E(O=O)=d kJ·mol-1。根据图示的分子结 构和有关数据估算该反应的 ΔH 是( )
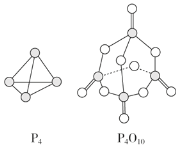
A.(4a+5d-4c-12b) kJ·mol-1B.(4c+12b-4a-5d) kJ·mol-1
C.(4c+12b-6a-5d) kJ·mol-1D.(6a+5d-4c-12b) kJ·mol-1
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F;
②R—CH=CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:________________。
(2)E的结构简式为_______________________。
(3)C与新制Cu(OH)2反应的化学方程式为________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式为____________________。
(6)以丙烯等为原料合成D的路线如下:

X的结构简式为________,步骤Ⅱ的反应条件为_________,步骤Ⅳ的反应类型为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯(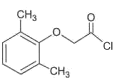 )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分一氯代烷的结构简式和沸点数据,下列对表中物质与数据的分析归纳,错误的是( )
物质代号 | 结构简式 | 沸点/℃ |
① |
|
|
② |
| 12.3 |
③ |
| 46.6 |
④ |
| 35.7 |
⑤ |
| 78.44 |
⑥ |
| 68.2 |
⑦ |
| 52 |
A.物质①②③⑤互为同系物
B.一氯代烷同分异构体的沸点随着支链的增多而升高
C.一氯代烷的沸点随着碳原子数的增多而升高
D.物质⑤与⑦互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为__________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________ (用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,则下列说法正确的是( )
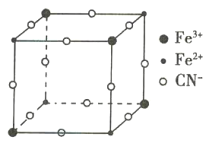
A.x=2,y=1
B.该晶体属于离子晶体,M呈+1价
C.M的离子不可能在立方体的体心位置
D.该晶胞中与每个Fe3+距离最近且相等的CN-有3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家对“液流电池”的研究取得新进展,一种新型的高比能量锌-碘溴液流电池工作原理如下图所示。下列有关叙述错误的是
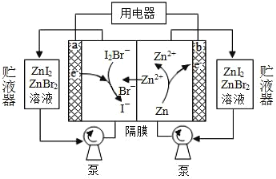
A.放电时,a 极电势高于 b 极
B.充电时,a 极电极反应为 I2Br-+2e-=2I-+Br-
C.图中贮液器可储存电解质溶液,提高电池的容量
D.导线中有 NA 个电子转移,就有 0.5 mol Zn2+通过隔膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com