
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】随着电动自行车市场保有量的不断增加,废弃的铅酸蓄电池已变成不容忽视的一种环境污染源,处理不当会加大对大气、水和土壤的污染。用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理废旧铅酸蓄电池的流程如下:
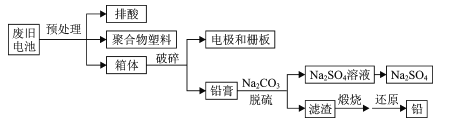
已知:Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=7.4×10-14
回答下列问题:
(1)废旧电池预处理时需要将电池放电完全,这样做的目的是____。
(2)写出铅膏脱硫时的离子方程式____。
(3)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是____。
(4)某同学查阅资料发现:儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍。为了探讨这个现象,展开了相关探究,他通过取样分析,得到了以下实验数据:
离地面高度 | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
铅的浓度(μg/cm3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
①该同学探究的课题名称为____。
②分析以上实验数据,可以得出的结论是___。
③造成此结果的原因可能是____。
(5)在走访调查中,小明同学收集了某铅酸蓄电池处理厂排出的废水样品,为了判断废水中含铅的浓度是否符合排放标准,他设计了如下方案并进行了实验:
![]()
上述实验中如果缺少操作M,所测得结果会 ___(填“偏大”、“偏小”、或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,其单质通常用作合金及不锈钢的添加剂,这种金属可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的主要流程:

(1)用简单氧化物形式表示![]() 的组成:____________________________。
的组成:____________________________。
(2)写出反应①的化学方程式:______________________。
(3)反应①的尾气可以再利用,写出两种利用该尾气制得的化学药品:______________________。
(4)工业上制备还原性气体的反应原理有: ,
, 。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(
。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(![]() 和
和![]() )依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知
)依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知![]() 的相对原子质量为96)
的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
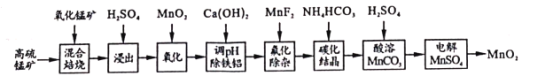
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)写出浸出时与铝元素有关的离子反应方程式____。
(2)上述“氧化”步骤是否可省略____(填“是”或“否”),你的依据是 _____。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为____;“氟化除杂”中除去的离子为____。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程___(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为____;整个流程中能够循环利用的物质除MnO2外还有___(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C. 点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 在整个滴定过程中:溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(a)常用作染料、医药、香料的中间体,a可转化为b(如图)。下列说法错误的是( )

A.常温下对伞花烃呈液态且难溶于水
B.b物质的一氯代物有5种
C.对伞花烃分子中最多有9个碳原子共平面
D.图中氢化反应既是加成反应也是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com