
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
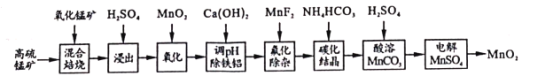
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)写出浸出时与铝元素有关的离子反应方程式____。
(2)上述“氧化”步骤是否可省略____(填“是”或“否”),你的依据是 _____。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为____;“氟化除杂”中除去的离子为____。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程___(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为____;整个流程中能够循环利用的物质除MnO2外还有___(写名称)。
【答案】Al2O3+6H+=3H2O+2Al3+ 否 若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会被部分沉淀,造成损失 5.0≤pH<7.5 Mg2+、Ca2+ 加入NH4HCO3后,Mn2+与HCO3-电离出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-电离出H+与另一部分HCO3-反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
【解析】
高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿混合焙烧,得到MnSO4、Fe2O3及少量FeO、Al2O3、MgO,加入硫酸,得到Mn2+、Fe2+、Fe3+、Mg2+、Al3+的酸性溶液,加入二氧化锰将亚铁离子氧化为铁离子便于除去,再加入碳酸钙中和,将铁离子与铝离子以氢氧化物的形式除去,加入MnF2除杂,使溶液中的Mg2+、Ca2+沉淀完全,此时溶液中的金属离子为锰离子,加入碳酸氢铵发生Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,加入硫酸溶解碳酸锰得到硫酸锰溶液,经过电解得到二氧化锰,据此分析解答。
(1)浸出时Al2O3与硫酸反应生成硫酸铝,与铝元素有关的离子反应方程式为:Al2O3+6H+=3H2O+2Al3+;
(2)根据沉淀表格数据,若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会被部分沉淀,造成损失,则上述“氧化”步骤不可省略;
(3)“调pH除铁铝’’时,根据数据,pH为5.0时铝离子完全沉淀,pH为7.5时锰离子开始沉淀,则生成沉淀的pH范围为5.0≤pH<7.5;根据分析,“氟化除杂”中加入MnF2除杂,使溶液中的Mg2+、Ca2+沉淀完全,除去的离子为Mg2+、Ca2+;
(4)加入NH4HCO3后,Mn2+与HCO3-电离出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-电离出H+与另一部分HCO3-反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
(5)用惰性电极电解MnSO4制备MnO2时,其阳极发生氧化还原,化合价升高失电子,锰元素由+2价升高为+4价,失电子被氧化,则阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+;硫酸根离子与氢离子结合生成硫酸,则整个流程中能够循环利用的物质除MnO2外还有硫酸。


科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
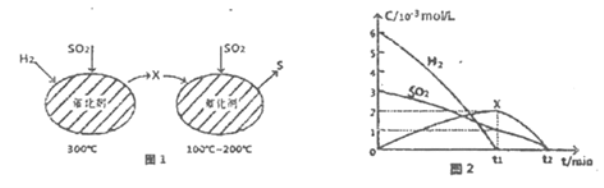
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/mol/L | c(H2)/mol/L | c(CH4)/mol/L | c(H2O)/mol/L | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
则a、b、c、d与m、n、x、y之间的关系式为_____________。
(3)已知相关物质的电离平衡常数如下表:

①0.1 mol·L-1的Na2CO3溶液的pH_______(填“大于”“小于”或“等于”)0.1 mol·L-1的Na2C2O4溶液的pH。
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中粒子浓度大小的顺序正确的是_________(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(CO32-)>c(C2O42-) d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个钛原子和12个氧原子紧相邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲 乙
乙 丙
丙 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学原理的说法正确的是
A.用惰性电极电解MgCl2饱和溶液可制得金属镁
B.用惰性电极电解CuCl2溶液时,阳极表面生成红色物质
C.在铁钉表面电镀铜时,将铁钉作阳极,铜作阴极,硫酸铜溶液为电解质
D.用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2:5,该反应的平衡常数K=___________;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将___________移动。(填“向正反应方向”“不”或“向逆反应方向”)
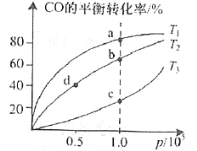
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是___________。b、d点的正反应速率vb(CO)_______va(CO).
(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
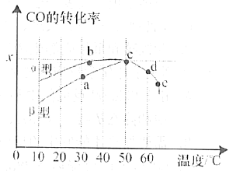
①a、b、c、d四点中表示平衡状态的是___________;
②e点转化率出现突变的原因可能是______________________。
(3)电解法转化CO2可实现CO2资源化利用。电解时CO2在阴极区转化为HCOOH,其原理示意图如下:
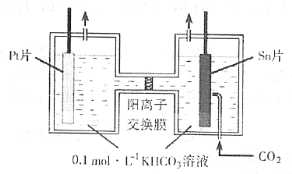
电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com