
【题目】如图是甲醇——空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是
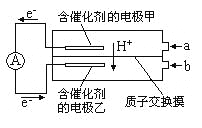
A. 正极反应式为:2H++2e—=H2↑
B. 乙电极为电池的负极,b处通入的物质是空气
C. 负极反应式为: CH3OH+H2O-6e—=CO2+6H+
D. 在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L
【答案】C
【解析】
该燃料电池的本质为:2CH3OH+3O2=2CO2+4H2O,所以电池总反应式为:2CH3OH+3O2=2CO2+4H2O,CH3OH发生氧化反应,应在负极通入;O2发生还原反应,应在正极通入.电子从甲电极流出,经外电路流入乙电极,所以甲电极为负极,乙电极为正极;
A、正极电极反应式为:3O2+12H++12e-=6H2O,选项A错误;
B、甲电极为负极,选项B错误;
C、电池总反应式减去正极电极反应式即为负极电极反应式,即:2CH3OH+2H2O-12e-=2CO2+12H+,选项C正确;
D、由池总反应式为:2CH3OH+3O2=2CO2+4H2O,可知,每消耗lmol氧气,理论上能生成标准状况下CO2气体22.4L×![]() =14.9L,选项D错误。
=14.9L,选项D错误。
答案选C。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下。

(1)“溶解”过程:生成CuSO4的反应方程式:CuO + H2SO4 === CuSO4 + H2O、________。
(2)“吸收”过程:
① 2NO(g) + O2(g) ![]() 2NO2(g) H = -112.6 kJ·mol-1
2NO2(g) H = -112.6 kJ·mol-1
提高NO平衡转化率的方法是________(写出两种)。
② 吸收NO2的有关反应如下:
反应Ⅰ:2NO2(g) + H2O(l) === HNO3(aq) + HNO2(aq) H = -116.1 kJ·mol-1
反应Ⅱ:3HNO2(aq) === HNO3(aq) + 2NO(g) + H2O(l) H = -75.9 kJ·mol-1
用水吸收NO2生成HNO3和NO的热化学方程式是________。
(3)“电解”过程:
HNO2为弱酸。通过电解使HNO3得以再生,阳极的电极反应式是________。
(4)“沉淀”过程:
① 产生CuCl的离子方程式是_________。
② 加入适量Na2CO3,能使沉淀反应更完全,原因是_________。
(5)测定CuCl含量:
称取氯化亚铜样品m g,用过量的FeCl3溶液溶解,充分反应后加入适量稀硫酸,用x mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液y mL。滴定时发生的离子反应:Cr2O72- + 6Fe2+ + 14H+ === 2Cr3+ + 6Fe3+ + 7H2O样品中CuCl(M=99.5 g·mol-1)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 向H2S水溶液中加入NaOH有利于S2-增多
B. H2、I2、HI混合气体加压后颜色变深
C. 合成氨时将氨液化分离,可提高原料的利用率
D. 新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,根据标签上的数据回答下列问题:

(1)取任意体积的该浓硫酸时,下列物理量会随所取体积的多少而发生变化的是________(选填相应字母编号)
A.溶液密度 B.溶液的物质的量浓度
C.溶液的质量分数 D.溶质的物质的量
(2)某学生欲用上述浓硫酸和蒸馏水配制450mL物质的量浓度为1.0mol·L-1的稀硫酸。
①该学生需要用量筒量取________mL上述浓硫酸进行配制。
②该实验中除了量筒、玻璃棒和烧杯外,还缺少的玻璃仪器有_________。
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线选择填写相应字母标号A、偏高;B、偏低;C、无影响)
I、用量筒量取浓硫酸时仰视凹液面读数_________
II、转移时容量瓶中已经有少量蒸馏水________
Ⅲ、定容时仰视刻度线__________
Ⅳ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.过量的KHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向稀氢氧化钠溶液中通入少量CO2:OH-+CO2===HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应机理、能量与反应进程的关系如图所示,下列说法正确的是

A. Fe2+是该反应的催化剂B. 第一步反应的能垒比第二步反应的小
C. S2O82-在第一步反应中作还原剂D. 两步反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下 列叙述不正确的是( )

A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com