
【题目】下列离子方程式正确的是
A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.过量的KHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向稀氢氧化钠溶液中通入少量CO2:OH-+CO2===HCO3-
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O都是红色粉末,常用作颜料.实验小组通过实验来探究某一红色粉末中Fe2O3和Cu2O的含量(不含其他物质)。
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为________。
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液![]() 过滤
过滤![]() 一系列操作
一系列操作![]() 绿矾晶体(FeSO4·7H2O)
绿矾晶体(FeSO4·7H2O)
试剂a为_____________(填化学式),“一系列操作”为__________、__________、过滤、洗涤、干燥。
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为_________________(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1∶2 时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为________(用小数表示,保留两位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式包括_______________
②写出FeCl3溶液与金属铜发生反应的化学方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
Ⅰ.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
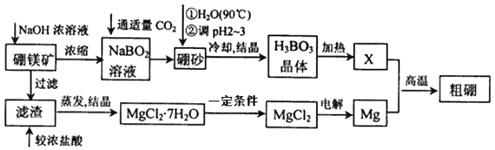
(1)写出硼元素在周期表中的位置___。
(2)将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取硼酸H3BO3,该反应的离子方秳式为___。
(3)由MgCl27H2O制备MgCl2时,一定条件是___。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.2000g粗硼制成的BI3完全分解,将生成的I2配制成100mL溶液,用酸式滴定管量取10mL碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用0.3000molL-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。(提示:I2+2S2O32-=2I-+S4O6)滴定终点的现象为___,该粗硼样品的纯度为___%。
Ⅱ(5)已知:H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/LNa2CO3溶液,__(填“能”或“不能”)观察到气泡逸出。
(6)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。
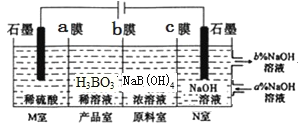
①b膜为__交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式:___理论上每生成1molH3BO3,阴极室可生成___L气体(标准状况)。
②N室中,进口和出口的溶液浓度大小关系为a%___b%(填“>”戒“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇——空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是
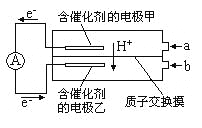
A. 正极反应式为:2H++2e—=H2↑
B. 乙电极为电池的负极,b处通入的物质是空气
C. 负极反应式为: CH3OH+H2O-6e—=CO2+6H+
D. 在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含磷及氨氮废水(PO43-、HPO42-、H2PO4-、NH4+、NH3·H2O等)并回收鸟粪石的一种工艺流程如下,下列说法错误的是
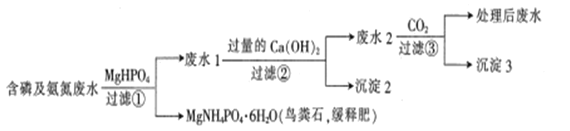
A. 除去水体中的磷和氨氮可防止水体富营养化并可回收利用氮磷
B. MgNH4PO4·6H2O的溶解度比MgHPO4的小
C. “过滤②”得到的“沉淀2"有Ca3(PO4)2及Mg(OH)2
D. 为简化流程,可将①②③的过滤步骤合并
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.制取乙酸乙酯时,饱和碳酸钠溶液作用:与乙酸反应生成乙酸钠溶解乙醇,降低乙酸乙酯的溶解度
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.乙烷中含有杂质乙烯,可用催化加氢的方式除去
D.等质量的![]() 、
、![]() 、
、![]() 分别在氧气中完全燃烧,消耗氧气的量依次增多
分别在氧气中完全燃烧,消耗氧气的量依次增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com