
【题目】硼、镁及其化合物在工农业生产中应用广泛。
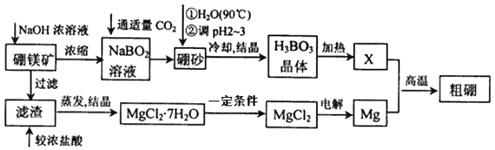
Ⅰ.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
(1)写出硼元素在周期表中的位置___。
(2)将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取硼酸H3BO3,该反应的离子方秳式为___。
(3)由MgCl27H2O制备MgCl2时,一定条件是___。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.2000g粗硼制成的BI3完全分解,将生成的I2配制成100mL溶液,用酸式滴定管量取10mL碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用0.3000molL-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。(提示:I2+2S2O32-=2I-+S4O6)滴定终点的现象为___,该粗硼样品的纯度为___%。
Ⅱ(5)已知:H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/LNa2CO3溶液,__(填“能”或“不能”)观察到气泡逸出。
(6)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。
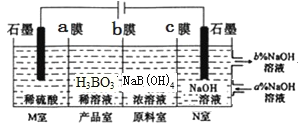
①b膜为__交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式:___理论上每生成1molH3BO3,阴极室可生成___L气体(标准状况)。
②N室中,进口和出口的溶液浓度大小关系为a%___b%(填“>”戒“<”)。
【答案】第二周期第ⅢA族 B4O72-+2H++5H2O=4H3BO3 在HCl氛围中加热 当滴入最后一滴Na2S2O3溶液时,溶液恰好由蓝色褪至无色,且半分钟不褪色 99% 不能 阴离子 H++[B(OH)4]-=H3BO3+H2O 11.2 <
【解析】
硼镁矿主要成分为Mg2B2O5H2O,硼镁矿加入氢氧化钠浓溶液,过滤得到滤渣为氢氧化镁,滤渣中加入浓盐酸得氯化镁溶液,通过蒸发浓缩得到氯化镁结晶水合物,为防止氯化镁水解,在氯化氢气流中加热得到氯化镁固体,电解熔融的氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂Na2B4O710H2O,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,加热得到B2O3;Mg与B2O3发生置换反应得到粗硼。
(1)B元素的原子序数为5,位于元素周期表中第二周期第ⅢA族;
(2)用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3,反应的离子方程式为B4O72-+2H++5H2O=4H3BO3;
(3)加热MgCl27H2O时,氯化镁水解生成氢氧化镁,在HCl氛围中加热可以抑制MgCl2的水解,由MgCl27H2O制备MgCl2时,一定条件是在HCl氛围中加热;
(4)将0.2000g粗硼制成的BI3完全分解,生成的I2用0.30molL-1Na2S2O3溶液滴定至终点,并选用淀粉作指示剂,达到滴定终点的现象为:当滴入最后一滴标准液时,溶液恰好由蓝色褪至无色,且半分钟不回复原色;消耗硫代硫酸钠的物质的量为:0.3000mol/L×0.018L=0.0054mol,根据关系式B~BI3~![]() I2~3S2O32-可知:n(B)=
I2~3S2O32-可知:n(B)=![]() n(S2O32-)=0.0054mol×
n(S2O32-)=0.0054mol×![]() =0.0018mol,硼的质量为:11g/mol×0.0018mol=0.0198g,则粗硼中硼的含量为:
=0.0018mol,硼的质量为:11g/mol×0.0018mol=0.0198g,则粗硼中硼的含量为:![]() ×100%=99%;
×100%=99%;
(5)H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7,因5.8×10-10<4.4×10-7,酸性H3BO3< H2CO3,所以不能观察到气泡逸出;
(6)①原料室中的[B(OH)4]-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,则b膜为阴离子交换膜、a膜为阳离子交换膜;产品室发生反应为:H++[B(OH)4]-=H3BO3+H2O; M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,根据得失电子守恒,理论上每生成1mol产品H3BO3,M室生成1molH+、N室生成0.5molH2,阴极生成的气体在标况下的体积:22.4L/mol×0.5mol=11.2L;
②N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室中:a%<b%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某烃类化合物A,其蒸汽对氢气的相对密度是42,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为____,名称为____。
(2)A中有多少碳原子处于同一平面____;
(3)已知A、B、C有如图转化关系:
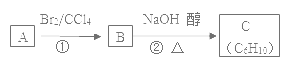
则反应②的化学方程式为___;反应的类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气具有很强的氧化性,工业上保存氯气通常使用干燥的钢瓶。但如果瓶口位置发生漏气,且漏气不明显时,我们可以使用浓氨水来检验。下列有关说法不正确的是( )
A.钢瓶盛装氯气前,如未能干燥氯气,则会有2Fe + 3Cl2 = 2FeCl3 反应发生
B.已知氯气与氨水反应为8NH3 + 3Cl2 = N2 + 6NH4Cl ,每有1mol Cl2参加反应,转移电子为2mol
C.氯气输送时应该使用金属管道或者抗腐蚀类高分子材料管道
D.自来水使用氯气进行消毒,是因为其氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质的量的相关公式,完成下列问题。(注意书写单位)
(1)3.01×1023个NH3分子的物质的量__。
(2)0.5molH2SO4含有的氧原子的物质的量__。
(3)2.3gNO2的物质的量__。
(4)标况下,33.6LN2的物质的量___。
(5)0.5mol /LK2SO4溶液中,c(K+)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 向H2S水溶液中加入NaOH有利于S2-增多
B. H2、I2、HI混合气体加压后颜色变深
C. 合成氨时将氨液化分离,可提高原料的利用率
D. 新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
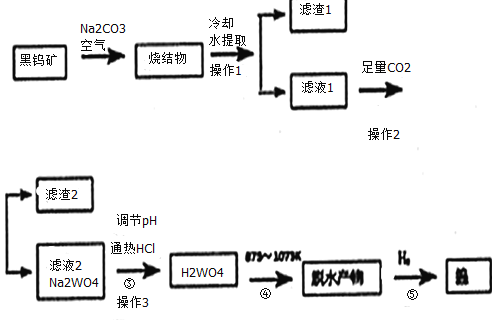
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.过量的KHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向稀氢氧化钠溶液中通入少量CO2:OH-+CO2===HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
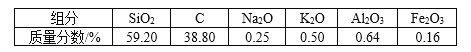
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
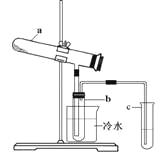
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com