
【题目】氯气具有很强的氧化性,工业上保存氯气通常使用干燥的钢瓶。但如果瓶口位置发生漏气,且漏气不明显时,我们可以使用浓氨水来检验。下列有关说法不正确的是( )
A.钢瓶盛装氯气前,如未能干燥氯气,则会有2Fe + 3Cl2 = 2FeCl3 反应发生
B.已知氯气与氨水反应为8NH3 + 3Cl2 = N2 + 6NH4Cl ,每有1mol Cl2参加反应,转移电子为2mol
C.氯气输送时应该使用金属管道或者抗腐蚀类高分子材料管道
D.自来水使用氯气进行消毒,是因为其氧化性
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
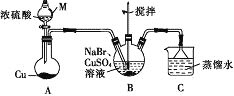
(1)仪器M的名称是________。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为______(填化学式)。
(3)B中发生反应的化学方程式为_______,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是_______(填标号)。
a.液溴 b.Na2SO4 c.铁粉 d.Na2S2O3
(4)下列关于过滤的叙述不正确的是_______ (填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁
b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是_______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O都是红色粉末,常用作颜料.实验小组通过实验来探究某一红色粉末中Fe2O3和Cu2O的含量(不含其他物质)。
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为________。
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液![]() 过滤
过滤![]() 一系列操作
一系列操作![]() 绿矾晶体(FeSO4·7H2O)
绿矾晶体(FeSO4·7H2O)
试剂a为_____________(填化学式),“一系列操作”为__________、__________、过滤、洗涤、干燥。
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为_________________(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在刚刚过去的一年中,发生了许多与化学相关的大事件.下列说法正确的是( )
A.被称为“史上最严”的新![]() 环境保护法
环境保护法![]() 正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染
正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染
B.天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭
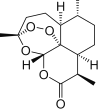
C.世界卫生组织认为青蒿素![]() 结构如图所示
结构如图所示![]() 联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
D.某品牌化妆品在广告中反复强调产品中不含任何化学成分,是“十年专注自然护肤”的优质产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是 ______ (填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾,请解释这一做法的原因: ______ (用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是 ______ (填字母)
a.福尔马林b.漂白粉c.氯气d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5molL-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 ______ 。
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理
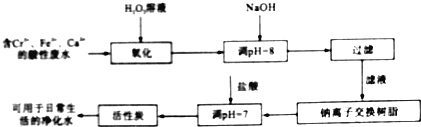
请回答下列问题
①写出加入双氧水后发生反应的离子方程式: ______ ;
②过滤操作需要的玻璃仪器是 ______ ;
③活性炭的作用是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:

已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。写出上述流程中生成亚硫酸铵的离子方程式:_______________________________。
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。

(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为________________过滤、洗涤。
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1∶2 时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为________(用小数表示,保留两位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式包括_______________
②写出FeCl3溶液与金属铜发生反应的化学方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
Ⅰ.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
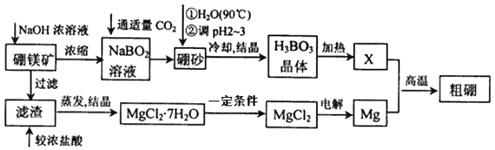
(1)写出硼元素在周期表中的位置___。
(2)将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取硼酸H3BO3,该反应的离子方秳式为___。
(3)由MgCl27H2O制备MgCl2时,一定条件是___。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.2000g粗硼制成的BI3完全分解,将生成的I2配制成100mL溶液,用酸式滴定管量取10mL碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用0.3000molL-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。(提示:I2+2S2O32-=2I-+S4O6)滴定终点的现象为___,该粗硼样品的纯度为___%。
Ⅱ(5)已知:H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/LNa2CO3溶液,__(填“能”或“不能”)观察到气泡逸出。
(6)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。
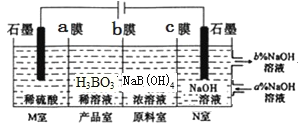
①b膜为__交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式:___理论上每生成1molH3BO3,阴极室可生成___L气体(标准状况)。
②N室中,进口和出口的溶液浓度大小关系为a%___b%(填“>”戒“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.制取乙酸乙酯时,饱和碳酸钠溶液作用:与乙酸反应生成乙酸钠溶解乙醇,降低乙酸乙酯的溶解度
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.乙烷中含有杂质乙烯,可用催化加氢的方式除去
D.等质量的![]() 、
、![]() 、
、![]() 分别在氧气中完全燃烧,消耗氧气的量依次增多
分别在氧气中完全燃烧,消耗氧气的量依次增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com