
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是 ______ (填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾,请解释这一做法的原因: ______ (用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是 ______ (填字母)
a.福尔马林b.漂白粉c.氯气d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5molL-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 ______ 。
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理
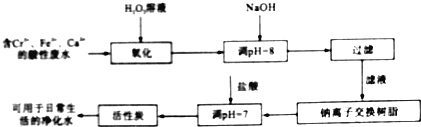
请回答下列问题
①写出加入双氧水后发生反应的离子方程式: ______ ;
②过滤操作需要的玻璃仪器是 ______ ;
③活性炭的作用是 ______ 。
【答案】bca Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)2(胶体) d 2.0×10-4molL-1 2Fe2++H2O2+2H+=2Fe3++2H2O 烧杯、漏斗、玻璃棒 吸附溶液在水中的杂质,并除去水中的异味
【解析】
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,故答案为:bca;
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体:4Fe2++O2+2H2O+8OH=4Fe(OH)3(胶体),从而起到较好的混凝作用,
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH=4Fe(OH)3(胶体);
③福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,
故答案为:d;
④Na2CO3溶液的浓度为5.6×105mol/L,等体积混合后溶液中c(CO32)=2.8×105mol/L,根据Ksp=c(CO32)c(Ca2+)=2.8×109可知,c(Ca2+)=![]() mol/L=1×104mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×104mol/L=2×104mol/L,
mol/L=1×104mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×104mol/L=2×104mol/L,
故答案为:2.0×104molL1;
(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+,然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+,过滤后滤液用钠离子交换树脂除去Ca2+,最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,
①过氧化氢可氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②过滤常用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
③活性炭具有吸附作用,可吸附溶解在水中的杂质,并除去水中的异味,
故答案为:吸附溶液在水中的杂质,并除去水中的异味。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A.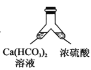 B.
B.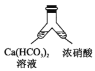 C.
C.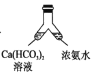 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
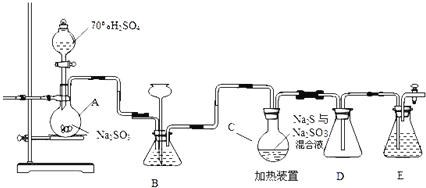
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为 ______
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 ______ 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 ______
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 ______ 。
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: ______ 。
已知:Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列物质:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥MgCl2 ⑦CaF2 ⑧CO2,其中只存在离子键的是:__(用序号回答,下同。);既存在离子键又存在共价键的是:__;试写出⑧的电子式:__;用电子式表示CaF2的形成过程___。
(2)在下列物质中,互为同素异形体的是__;互为同位素的是__。
①液氨和氨气 ②D2和T2 ③![]() K和
K和![]() Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气具有很强的氧化性,工业上保存氯气通常使用干燥的钢瓶。但如果瓶口位置发生漏气,且漏气不明显时,我们可以使用浓氨水来检验。下列有关说法不正确的是( )
A.钢瓶盛装氯气前,如未能干燥氯气,则会有2Fe + 3Cl2 = 2FeCl3 反应发生
B.已知氯气与氨水反应为8NH3 + 3Cl2 = N2 + 6NH4Cl ,每有1mol Cl2参加反应,转移电子为2mol
C.氯气输送时应该使用金属管道或者抗腐蚀类高分子材料管道
D.自来水使用氯气进行消毒,是因为其氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下。

(1)“溶解”过程:生成CuSO4的反应方程式:CuO + H2SO4 === CuSO4 + H2O、________。
(2)“吸收”过程:
① 2NO(g) + O2(g) ![]() 2NO2(g) H = -112.6 kJ·mol-1
2NO2(g) H = -112.6 kJ·mol-1
提高NO平衡转化率的方法是________(写出两种)。
② 吸收NO2的有关反应如下:
反应Ⅰ:2NO2(g) + H2O(l) === HNO3(aq) + HNO2(aq) H = -116.1 kJ·mol-1
反应Ⅱ:3HNO2(aq) === HNO3(aq) + 2NO(g) + H2O(l) H = -75.9 kJ·mol-1
用水吸收NO2生成HNO3和NO的热化学方程式是________。
(3)“电解”过程:
HNO2为弱酸。通过电解使HNO3得以再生,阳极的电极反应式是________。
(4)“沉淀”过程:
① 产生CuCl的离子方程式是_________。
② 加入适量Na2CO3,能使沉淀反应更完全,原因是_________。
(5)测定CuCl含量:
称取氯化亚铜样品m g,用过量的FeCl3溶液溶解,充分反应后加入适量稀硫酸,用x mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液y mL。滴定时发生的离子反应:Cr2O72- + 6Fe2+ + 14H+ === 2Cr3+ + 6Fe3+ + 7H2O样品中CuCl(M=99.5 g·mol-1)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 向H2S水溶液中加入NaOH有利于S2-增多
B. H2、I2、HI混合气体加压后颜色变深
C. 合成氨时将氨液化分离,可提高原料的利用率
D. 新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下 列叙述不正确的是( )

A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com