
����Ŀ�������ҹ����Ԫ�ء�����ר�Ҿ������ڿ���������2016��Ԫ��ȷ�Ͻ���ʡ�����ش����������������ٿӶ���һ��ȷ���˽���ʡ�������ٶ����ĵ�λ����Ȼ�������в��������٣�+6�ۣ����ε���ʽ���ڡ����ٿ����Ҫ�ɷ��������̵������Σ�FeWO4��MnWO4��������SiO2��Al2O3�����ʡ����ú��ٿ��Ʊ������ٵ�����ͼ��ͼ��
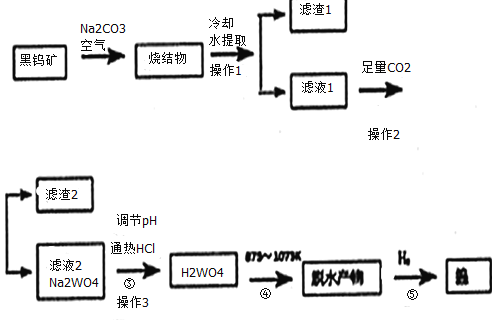
˵����a����Ӧ�����ڸ��������½��еģ��ս���ɷ�Ϊ��Fe2O3��Mn2O4��NaAlO2��Na2SiO3��Na2WO4
b������Fe2O3�ķ�ӦΪ��4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c����pHֵ3.0��4.4������Һ�У���������������������ʷ��룬���պ�Ϊ��������
�ش��������⣺
��1��д���ս���������Na2SiO3�Ļ�ѧ��Ӧ����ʽ��__������Mn2O4������Fe2O3�������ķ�Ӧԭ����ͬ����д������Mn3O4�Ļ�ѧ��Ӧ����ʽ��___��
��2������3��Ҫ�õ������������У�__��
��3��ͨ������CO2ʱ���������ӷ�Ӧ����ʽΪ��___��___��
��4������������������ٵ��Ʊ����ڹ�ҵұ�������ĺ��ַ���___��
��5���ҹ��ٻ�ѧ�о��ĵ���˹�����������������ķ�Ӧ�Ƶ���һ�ֻ�ɫ�ġ������ȵ��ٵ�������WO��3-x����������ɫ�����پ��бȱ������ԭ���ŵ㡣һ����Ϊ����ɫ�����ٵ���ɫ�ͷ����Ȱ�ʾ���ڻ������д�������ۺ�����������״̬���٣���x��ֵΪ0.1������ɫ�������������ּ�̬����ԭ����֮��Ϊ___��
���𰸡�Na2CO3+SiO2![]() Na2SiO3+CO2�� 6MnWO4+6Na2CO3+O2=6Na2WO4+6CO2+2Mn3O4 ���������ձ���©�� CO2+AlO2-+2H2O=Al��OH��3��+HCO3- 2CO2+SiO32-+2H2O=H2SiO3��+2HCO3- �Ȼ�ԭ�� 1��4
Na2SiO3+CO2�� 6MnWO4+6Na2CO3+O2=6Na2WO4+6CO2+2Mn3O4 ���������ձ���©�� CO2+AlO2-+2H2O=Al��OH��3��+HCO3- 2CO2+SiO32-+2H2O=H2SiO3��+2HCO3- �Ȼ�ԭ�� 1��4
��������
���ٿ����Ҫ�ɷ��������̵������Σ�FeWO4��MnWO4��������SiO2��Al2O3�������ڿ����м��������������ڣ��ս���ɷ�Ϊ��Fe2O3��Mn2O4��NaAlO2��Na2SiO3��Na2WO4����ȴ�ܽ���˵õ���ҺA����pHֵ3.0��4.4������Һ�У����������������B�����ʷ��룬���պ�Ϊ�������٣�������ԭ�����ٵõ������٣��ݴ˷�������
��1��̼���ƺͶ��������ϼ��ȷ�Ӧ���ɹ����ƺͶ�����̼���ս���������Na2SiO3�Ļ�ѧ��Ӧ����ʽΪ��Na2CO3+SiO2![]() Na2SiO3+CO2������Ϸ�Ӧ4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3������Mn2O4������Fe2O3�������ķ�Ӧԭ����ͬ�����Ƶõ���MnWO4��Na2CO3������е�������Ӧ����Na2WO4��CO2��Mn3O4����������Mn3O4�Ļ�ѧ��Ӧ����ʽΪ��6MnWO4+6Na2CO3+O2=6Na2WO4+6CO2+2Mn3O4��
Na2SiO3+CO2������Ϸ�Ӧ4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3������Mn2O4������Fe2O3�������ķ�Ӧԭ����ͬ�����Ƶõ���MnWO4��Na2CO3������е�������Ӧ����Na2WO4��CO2��Mn3O4����������Mn3O4�Ļ�ѧ��Ӧ����ʽΪ��6MnWO4+6Na2CO3+O2=6Na2WO4+6CO2+2Mn3O4��
��2������3Ϊ������Һ����Ĺ��˲�������Ҫ�õ������������У����������ձ���©����
��3����Һ1��ͨ�����������̼����Һ��ƫ��������Ӻ���������̼��Ӧ������������������̼�����ƣ�ͨ������CO2ʱ���������ӷ�Ӧ����ʽΪ��CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��������̼��������ӷ�Ӧ���ɰ�ɫ�������ᣬ��Ӧ�����ӷ���ʽΪ��2CO2+SiO32-+2H2O=H2SiO3��+2HCO3-��
��4��������֪��H2WO4��ˮ����ΪWO3��ͨ��������ԭ�����ٽ�����WO3+3H2![]() W+3H2O��ұ���ķ��������Ȼ�ԭ����
W+3H2O��ұ���ķ��������Ȼ�ԭ����
��5���ٵ�������WO��3-x����x=0.1�����ٵ�������ΪWO2.9�����������Ϊx�������۵���Ϊ��1-x�������ݻ��ϼ۴����͵���0��5x+6(1-x)=2.9��2,x=0.2������ۺ�����������״̬���ٵı�Ϊ0.2��(1-0.2)=1:4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X����Y��Һ�У����ɳ��������ʵ���n2������X�����ʵ���n1�Ĺ�ϵ��ͼ��ʾ��������ͼ��ʾ�������
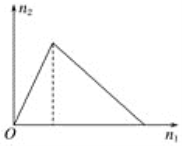
A. XΪ�������ƣ�YΪ�Ȼ���
B. XΪ�Ȼ�����YΪ��������
C. XΪ���ᣬYΪ���ǻ���������
D. XΪ���ǻ��������ƣ�YΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������꿱�⣬2018��11��23��ʡ��Ȼ��Դ��������Ϣ��������������ش�ͭ�������ش�ʵ�����塣�Ի�ͭ��(��Ҫ�ɷ�ΪCuFeS2,��������PbS��Al2O3��SiO2)Ϊԭ����ȡ��������������ͼ��

��֪��������Ksp[Fe(OH)3]=8.0��10-38, Ksp[Al(OH)3]=3.0��10-33��Ksp[Cu(OH)2]=3.0��10-20��
��1��CuFeS2����Ԫ�صĻ��ϼ�Ϊ______����Ԫ�������ڱ��е�λ����______________��д����������������������淋����ӷ���ʽ��_______________________________��
��2�����ʺϵ��Լ�A��________��д��ѧʽ����Һ������2�ijɷ�ΪPbSO4��_______�����Լ�A��Ũ��Ϊ6mol��L-1ʱ ����������ʵ���У�ͭ�Ľ����ʽ����ͼ��ʾ�������õ����ʵ������(�¶ȡ�ʱ��)Ϊ_______________��

��3�����ʺϵ��Լ�B��_______(�����)�����ʺϵ��Լ�C��______������ţ�������3�ijɷ�Ϊ_________________________��
a��Cl2 b��CuO c�����Ը��������Һ d��NaOH e��H2O2 ��Һ f��K2CO3
��4������1����ʵ�����н��У��õ��IJ����������ձ�����������_______������2�IJ���Ϊ________________���ˡ�ϴ�ӡ�
��5��������֪��Ϣ������㣺��Fe3+��ȫ����ʱ����Һ��Al3+�������Ũ��Ϊ______������ʾ��������Ũ����1��10-5mol��Lʱ����Ϊ�����ӳ�����ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol/L CH3COONa��ҺpH=9��������˵����ȷ����
A. ��������NaOH�������ҺpHС��9
B. ��ˮϡ�ͣ�CH3COONaˮ��̶�����c(OH-)����
C. ����Һˮ�������c(OH-)=10-9
D. CH3COOH�ڳ�����Ka��ֵԼΪ1��10-5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
����֪��þ����Ҫ�ɷ�ΪMg2B2O5H2O����ɰ�Ļ�ѧʽΪNa2B4O710H2O��һ��������þ����ȡ����þ������Ĺ���������ͼ��ʾ��
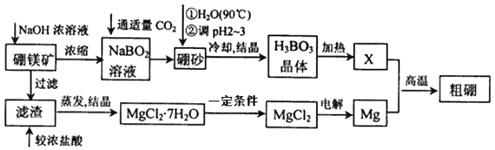
��1��д����Ԫ�������ڱ��е�λ��___��
��2������ɰ������ˮ�������������Һ��pHΪ2��3����ȡ����H3BO3���÷�Ӧ�����ӷ���ʽΪ___��
��3����MgCl27H2O�Ʊ�MgCl2ʱ��һ��������___��
��4���ƵõĴ�����һ������������BI3��BI3���ȷֽ���Եõ������ĵ������ֽ�0.2000g�����Ƴɵ�BI3��ȫ�ֽ⣬�����ɵ�I2���Ƴ�100mL��Һ������ʽ�ζ�����ȡ10mL��ˮ��Һ������ƿ�У������еμӼ��ε�����Һ����0.3000molL-1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ18.00mL������ʾ��I2+2S2O32-=2I-+S4O6���ζ��յ������Ϊ___���ô�����Ʒ�Ĵ���Ϊ___%��
��5����֪��H3BO3�ĵ��볣��Ϊ5.8��10-10��H2CO3�ĵ��볣��ΪK1=4.4��10-7��K2=4.7��10-11����ʢ�б���������Һ���Թ��У��μ�0.1mol/LNa2CO3��Һ��__�����������������������۲쵽�����ݳ���
��6��H3BO3[Ҳ��д��B��OH��3]����ͨ�����NaB��OH��4��Һ�ķ����Ʊ�������ԭ����ͼ��ʾ�������ӽ���Ĥ�������ӽ���Ĥ�ֱ�ֻ���������ӡ�������ͨ������
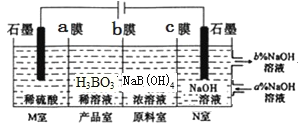
��bĤΪ__����Ĥ������������������������������д����Ʒ�ҷ�����Ӧ�����ӷ���ʽ��___������ÿ����1molH3BO3�������ҿ�����___L���壨��״������
��N���У����ںͳ��ڵ���ҺŨ�ȴ�С��ϵΪa%___b%����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH��������������ȷ����
3Zn(OH)2+2Fe(OH)3+4KOH��������������ȷ����
A. �ŵ�ʱ������ӦʽΪ3Zn-6e-+6OH-=3Zn(OH)2
B. ���ʱ������ӦʽΪ2Fe(OH)3+10OH--6e-=2FeO42-+8H2O
C. �ŵ�ʱÿת��3 mol���ӣ�������1 mol K2FeO4����ԭ
D. �ŵ�ʱ����������Һ�ļ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ˮ(PO43����HPO42����H2PO4����NH4����NH3��H2O��)���������ʯ��һ�ֹ����������£�����˵���������
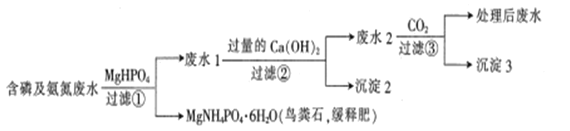
A. ��ȥˮ���е��Ͱ����ɷ�ֹˮ�帻Ӫ�������ɻ������õ���
B. MgNH4PO4��6H2O���ܽ�ȱ�MgHPO4��С
C. �����ˢ����õ��ġ�����2"��Ca3(PO4)2��Mg(OH)2
D. Ϊ�����̣��ɽ��٢ڢ۵Ĺ��˲���ϲ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ��ѭ��������Ŀǰ�о����ȵ�֮һ��
��1��һ�ֿ��Կ��������İ��������ͼa��ʾ��
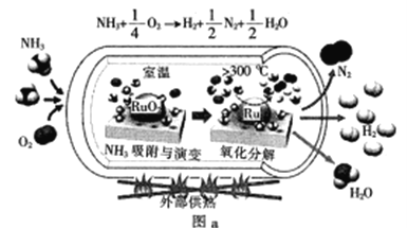
��֪��![]()
![]()
�������ⷴӦ��![]() ��
��![]() ��__
��__![]()
��2��1100��ʱ������˿����NH3�ֽ�İ�˥��(Ũ�ȼ�Сһ������ʱ��)���±���ʾ��
c(NH3)/mol/L | 4.56��10-3 | 2.28��10-3 | 1.14��10-3 | 5.70��10-4 | 2.85��10-4 |
ʱ��/s | 0 | 440 | 660 | 770 | t5 |
���е�t5��ֵΪ_________��c(NH3)��ֵ��4.56��10��3�仯��2.28��10��3�Ĺ����У�ƽ����Ӧ������v(H2)=_____________ (������λ��Ч����)mol��L��1��S��1��
��3����101kPa�£�NH3�ֽ��ƽ��ת�������¶ȵĹ�ϵ��ͼb��ʾ��
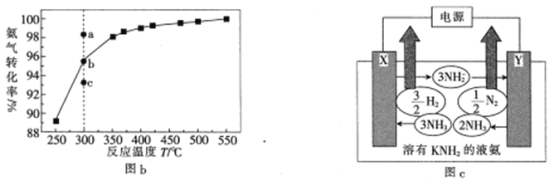
���¶�Ϊ300�棬��ѹΪ101kPaʱ��ͼb��v(��)>v(��)�ĵ���_____(�a����b����c��)��
��Ϊ����NH3�ֽ�Ļ�ܿɲ�ȡ�Ĵ�ʩ��_____________________________
��4����֪Һ���д�������ƽ�⣺2NH3(l)![]() NH4����NH2���������н�������������(��KNH2)��Һ��������ʵ������Ĺ���ԭ����ͼc��ʾ��
NH4����NH2���������н�������������(��KNH2)��Һ��������ʵ������Ĺ���ԭ����ͼc��ʾ��
�ٵ缫X��������__________________(���������������)��
��ͼc�������ĵ缫��ӦʽΪ______________________________________________
����ͼc��֧�ֵ���ʸ���NH4Cl���������ĵ缫��ӦʽΪ__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����agij���������������г��ȼ���ٽ�����������ͨ��������Na2O2��ַ�Ӧ����������Ϊbg����a<b��������ʿ����ǣ� ��
A. H2B. COC. ����(CH3COOH)D. ����(CH4)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com