
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是
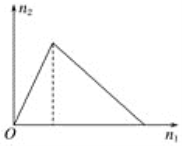
A. X为氢氧化钠,Y为氯化铝
B. X为氯化铝,Y为氢氧化钠
C. X为盐酸,Y为四羟基合铝酸钠
D. X为四羟基合铝酸钠,Y为盐酸
【答案】C
【解析】
A. 氢氧化钠溶液加入氯化铝溶液中,先发生反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH=Na[Al(OH)4],沉淀溶解至最后消失,所以前后两个过程氢氧化钠的物质的量之比为3:1,不符合图中所示情况,A项错误;
B. 氯化铝溶液滴入氢氧化钠溶液中,先发生反应Al3++4OH-=[Al(OH)4]-,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应3[Al(OH)4]-+Al3+=4Al(OH)3↓,生成沉淀,不符合图中所示情况,B项错误;
C. 盐酸加入Na[Al(OH)4]溶液中,先发生反应[Al(OH)4]-+H+=Al(OH)3↓+H2O,生成Al(OH)3沉淀,当Na[Al(OH)4]溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+=Al3++3H2O,沉淀消失,所以前后两个过程HCl的物质的量之比为1:3,符合图中所示情况,C项正确;
D. Na[Al(OH)4]溶液加入盐酸中,先发生反应[Al(OH)4]-+4H+=Al3++4H2O,不生成沉淀,当盐酸溶液反应完后,再滴入Na[Al(OH)4]溶液,发生反应3[Al(OH)4]-+Al3+=4Al(OH)3↓,生成沉淀直到最大,不符合图中所示情况,D项错误;
答案选C。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】如图列出主要物质间的转化关系,其中X、Y可能是
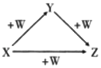
①NaOH、Na2CO3 ②KAlO2、Al(OH)3 ③Fe、Fe(NO3)2 ④S、SO2 ⑤SiO2、Na2SiO3 ⑥NH3、NO
A.①②⑥B.②③④
C.①④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),有极强的还原性,受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧,不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
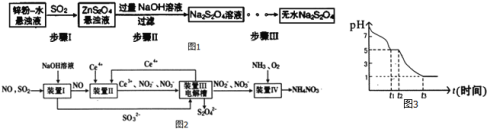
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图1所示:
①须将锌粉和水制成悬浊液的原因是 ______ ;若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是 ______
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②步骤III过程较为复杂,其中涉及过滤、洗涤、干燥等操作,请写出洗涤过程的操作方法: ______ 。
(2)吸收大气污染物SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 ______
②装置III中电解槽阴极发生的电极反应为 ______ 。
③已知进入装置IV的溶液中,NO2-的浓度为a gL-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2 ______ L。(用含a代数式表示,计算结果保留整数)
(3)课题小组测定0.050molL-1Na2S2O4溶液在空气中pH变化如图3,0-t1段主要生成HSO3-,则0-t1发生离子反应方程式为 ______ ,t1时刻溶液中离子浓度由大到小的顺序是 ______ ,t3时溶液中主要阴离子符号是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物不止一种的是( )
A. CH3CH2CH2Br在碱性溶液中水解
B. 甲苯在催化剂作用下与Cl2发生苯环上的取代反应
C. ![]() 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
D. ![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A,其蒸汽对氢气的相对密度是42,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为____,名称为____。
(2)A中有多少碳原子处于同一平面____;
(3)已知A、B、C有如图转化关系:
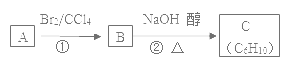
则反应②的化学方程式为___;反应的类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】31.04gFe3O4、Fe2O3、FeO组成的固体混合物,用180 mL6.0 mol·L-1盐酸能恰好将之完全溶解。若将此固体混合物用CO完全还原,则生成的铁的物质的量为
A.0.2molB.0.3molC.0.4molD.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制碱制得的纯碱中含有NaHCO3和NaCl杂质。某实验小组对此碱样品进行检查。
(1)取此碱样品10g,加热到质量不再减少,冷却称重,称得质量为9.845g,该样品中NaHCO3的质量分数为__________________________。
(2)另取10g固体样品,加蒸馏水溶解,配成250mL一定物质的量浓度的溶液,配制过程中必需使用的化学仪器有______________________(填字母)
A.烧杯 B.250mL容量瓶C.漏斗 D.胶头滴管 E.玻璃棒 F.试管
(3)量取上述配制好的溶液25mL,向其中加入过量盐酸至 不再产生气泡,共收集到190.4mL(标准状况)气体,该反应过程的离子方程式为______________________、_______________________。10g该样品中含____________gNaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是
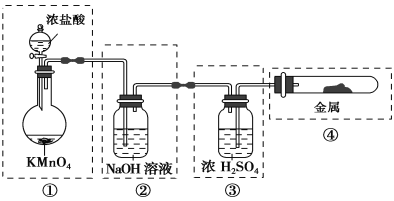
A. ①和②B. ②C. ②和③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
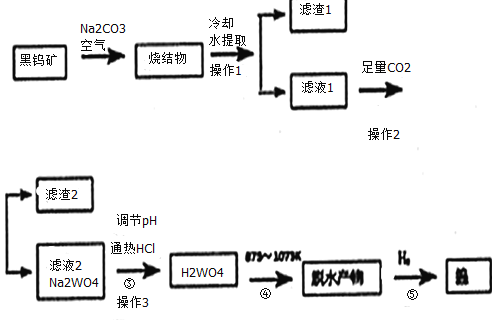
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com