
【题目】已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是
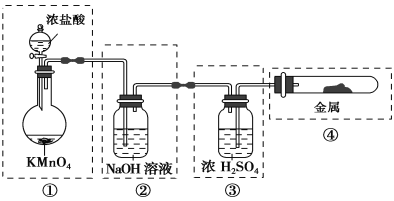
A. ①和②B. ②C. ②和③D. ②③④
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
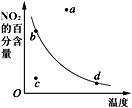
A. a点B. b点C. c点D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是
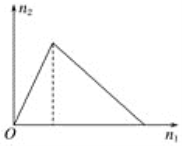
A. X为氢氧化钠,Y为氯化铝
B. X为氯化铝,Y为氢氧化钠
C. X为盐酸,Y为四羟基合铝酸钠
D. X为四羟基合铝酸钠,Y为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在刚刚过去的一年中,发生了许多与化学相关的大事件.下列说法正确的是( )
A.被称为“史上最严”的新![]() 环境保护法
环境保护法![]() 正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染
正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染
B.天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭
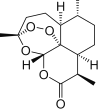
C.世界卫生组织认为青蒿素![]() 结构如图所示
结构如图所示![]() 联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
D.某品牌化妆品在广告中反复强调产品中不含任何化学成分,是“十年专注自然护肤”的优质产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:

已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。写出上述流程中生成亚硫酸铵的离子方程式:_______________________________。
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。

(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为________________过滤、洗涤。
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L CH3COONa溶液pH=9,则下列说法正确的是
A. 加入少量NaOH固体后溶液pH小于9
B. 加水稀释,CH3COONa水解程度增大,c(OH-)增大
C. 该溶液水电离出的c(OH-)=10-9
D. CH3COOH在常温下Ka数值约为1×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨能源的循环利用是目前研究的热点之一。
(1)一种可以快速启动的氨制氢工艺如图a所示:
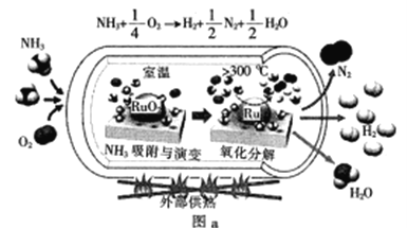
已知:![]()
![]()
快速制氢反应:![]() 的
的![]() =__
=__![]()
(2)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:
c(NH3)/mol/L | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为_________:c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=_____________ (保留三位有效数字)mol·L-1·S-1。
(3)在101kPa下,NH3分解的平衡转化率与温度的关系如图b所示:
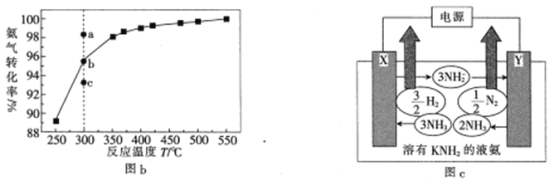
①温度为300℃,总压为101kPa时,图b中v(正)>v(逆)的点是_____(填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有_____________________________
(4)已知液氮中存在下列平衡:2NH3(l)![]() NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
①电极X的名称是__________________(填“阳极”或“阴极”)。
②图c中阳极的电极反应式为______________________________________________
③若图c中支持电解质改用NH4Cl,则阴极的电极反应式为__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com