
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
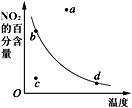
A. a点B. b点C. c点D. d点
【答案】C
【解析】
当温度一定时,NO2的百分含量也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态。在曲线下方的任意一点,要想达到同温度下的平衡状态,应该向上引垂直线到曲线上的一点,这样NO2的百分含量要增大,平衡向右移动;而在曲线上方的任意一点,要想达到同温度下的平衡状态,则应该向下引垂直线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动。
A、a点在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,需要由a点向下引垂直线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动,故v(正)<v(逆),故不选A;
B、b点在曲线上,处于平衡状态,v(正)=v(逆),故不选B;
C、c点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,需要由c点向上引垂直线到曲线上的一点,这样NO2的百分含量要增大,平衡向右移动,故v(正)>v(逆),故选C;
D、d点在曲线上,处于平衡状态,v(正)=v(逆),故不选D;
本题答案选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】科学家用![]() Ca轰击
Ca轰击![]() Bk(锫)生成
Bk(锫)生成![]() Up和
Up和![]() Up,Up可能是科学家一直寻找的第117号元素。下列关于
Up,Up可能是科学家一直寻找的第117号元素。下列关于![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up说法中正确的是( )
Up说法中正确的是( )
A. 117号元素的相对原子质量为293.5
B. ![]() Up和
Up和![]() Up互为同位素
Up互为同位素
C. ![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up表示四种核素,属于四种元素
Up表示四种核素,属于四种元素
D. 该轰击表明通过化学反应可以合成新元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图列出主要物质间的转化关系,其中X、Y可能是
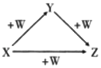
①NaOH、Na2CO3 ②KAlO2、Al(OH)3 ③Fe、Fe(NO3)2 ④S、SO2 ⑤SiO2、Na2SiO3 ⑥NH3、NO
A.①②⑥B.②③④
C.①④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
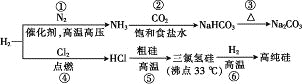
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A. NH3(g)+![]() O2(g)=
O2(g)=![]() N2(g)+
N2(g)+![]() H2O(g);ΔH= -a kJ·mol-1
H2O(g);ΔH= -a kJ·mol-1
B. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);ΔH= -b kJ·mol-1
C. C(s)+H2O(g)=CO(g)+H2(g);ΔH= -c kJ·mol-1
D. CH3CH2OH(l)+![]() O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-1
O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),有极强的还原性,受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧,不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
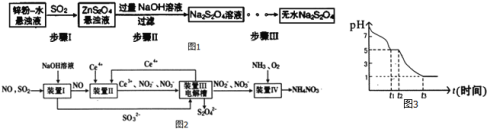
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图1所示:
①须将锌粉和水制成悬浊液的原因是 ______ ;若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是 ______
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②步骤III过程较为复杂,其中涉及过滤、洗涤、干燥等操作,请写出洗涤过程的操作方法: ______ 。
(2)吸收大气污染物SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 ______
②装置III中电解槽阴极发生的电极反应为 ______ 。
③已知进入装置IV的溶液中,NO2-的浓度为a gL-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2 ______ L。(用含a代数式表示,计算结果保留整数)
(3)课题小组测定0.050molL-1Na2S2O4溶液在空气中pH变化如图3,0-t1段主要生成HSO3-,则0-t1发生离子反应方程式为 ______ ,t1时刻溶液中离子浓度由大到小的顺序是 ______ ,t3时溶液中主要阴离子符号是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物不止一种的是( )
A. CH3CH2CH2Br在碱性溶液中水解
B. 甲苯在催化剂作用下与Cl2发生苯环上的取代反应
C. ![]() 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
D. ![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是
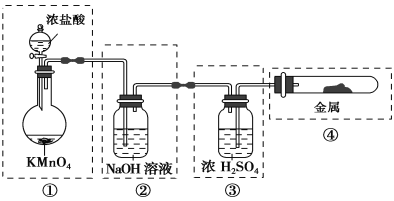
A. ①和②B. ②C. ②和③D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com