
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2 > Fe3+ >SO2,某化学研究性学习小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
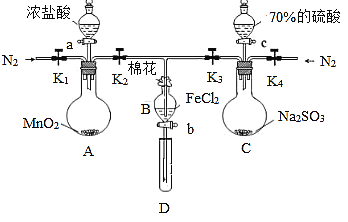
Ⅰ.打开弹簧夹K1—K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
回答下列问题:
(1)过程Ⅰ的目的是________。
(2)棉花中浸润的溶液为________,作用是_____________。
(3)导致步骤Ⅲ中溶液变黄的离子反应是____,用_____,(写试剂化学式)检验氧化产物,现象是____。
(4)能说明氧化性Fe3+>SO2的离子方程式是________。
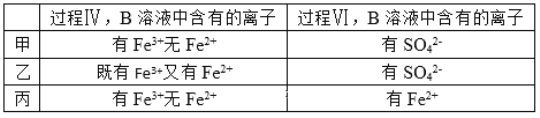
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2> Fe3+>SO2的是__(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L四氯化碳分子数为NA
B. 常温下,16gO2和O3组成的混合气体中所含有的原子数为NA
C. 常温下,1mol/L的AlCl3溶液中含有的Cl-离子数为3NA
D. 18gNH4+离子中所含的电子总数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物中含有KAl(SO4)2和另外两种金属氧化物,在一定条件下可实现下图所示物质间转化:
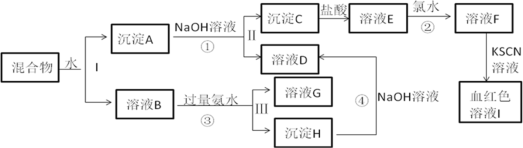
已知:Cl2+2Fe2+==2Fe3++2Cl-
请回答下列问题:
(1)沉淀H的化学式_________,框图中血红色物质是______(填化学式)
(2)Ⅰ、Ⅱ、Ⅲ分离操作中所需的玻璃仪器除烧杯、玻璃棒外还需要___________。
(3)反应①的离子方程式是____________。
(4)检验溶液G中金属阳离子的操作方法和现象是___________。
(5)若在E中加入KSCN溶液,溶液不变色,则沉淀C是________(填名称);
若在E中加入KSCN溶液,溶液变红色,为进一步确认沉淀C的成分,进行如下定量实验: 将沉淀C用5mol/L盐酸14mL恰好完全溶解,所得溶液还能吸收标准状况下56mL氯气,使其中Fe2+全部转化为Fe3+。则沉淀C可能的化学式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
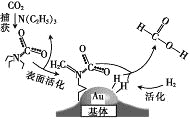
A. 标准状况下,22.4L CO2中所含的电子数目为16NA
B. 10.1g N(C2H5)3中所含的非极性共价键数目为0.3NA
C. 2mol Au与2mol H2中所含的分子数目均为2NA
D. 100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
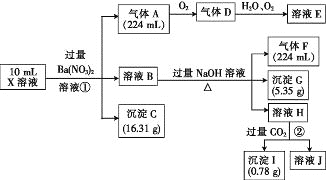
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是
A.用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
B.向CH3CH2Br中滴入AgNO3溶液以检验溴元素
C.用溴的四氯化碳溶液吸收SO2气体
D.![]() 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
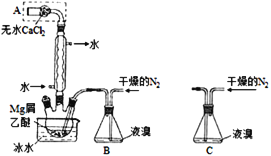
图1 图2
步骤1、三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴;
步骤2、缓慢通入干燥的氮气,直至溴完全导入三颈瓶中;
步骤3、反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4、室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______;
(2)实验中不能用干燥空气代替干燥N2,原因是______________;
(3)步骤3中,第一次过滤除去的物质是_________________;
(4)有关步骤4的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2
①滴定管洗涤前的操作是_______________________;
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com