
【题目】为验证氧化性:Cl2 > Fe3+ >SO2,某化学研究性学习小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
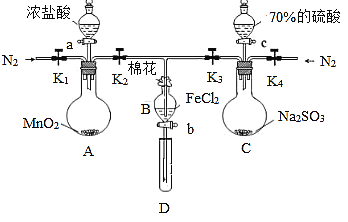
Ⅰ.打开弹簧夹K1—K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
回答下列问题:
(1)过程Ⅰ的目的是________。
(2)棉花中浸润的溶液为________,作用是_____________。
(3)导致步骤Ⅲ中溶液变黄的离子反应是____,用_____,(写试剂化学式)检验氧化产物,现象是____。
(4)能说明氧化性Fe3+>SO2的离子方程式是________。
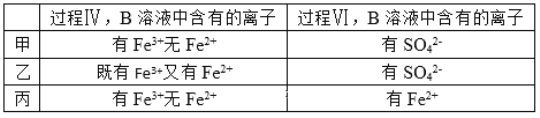
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2> Fe3+>SO2的是__(填“甲”“乙”“丙”)。
【答案】赶走装置内的空气,避免空气中的氧气影响实验 氢氧化钠溶液 吸收反应中多余的氯气、二氧化硫气体,防止污染空气 2Fe2+ + Cl2 === 2Fe3+ + 2Cl- KSCN溶液 红色 2Fe3++SO2 +2H2O === 2Fe2++SO42-+4H+ 乙、丙
【解析】
将装置内的空气排出,避免空气中氧气干扰实验,实验室制得的氯气先通入到氯化亚铁溶液中,溶液变黄,用KSCN溶液验证是否生成了铁离子,关闭氯气,再利用生成的二氧化硫通入到B溶液中,检验B中的离子。
⑴打开弹簧夹,通入一段时间氮气,目的是赶走装置内的空气,避免空气中的氧气影响实验,
故答案为赶走装置内的空气,避免空气中的氧气影响实验;
⑵棉花上的溶液主要是吸收反应中多余的氯气、二氧化硫气体,防止污染空气,因此棉花应该浸润的为氢氧化钠溶液,
故答案为氢氧化钠溶液;吸收反应中多余的氯气、二氧化硫气体,防止污染空气;
⑶氯气具有强氧化性,能够把氯化亚铁氧化为氯化铁,含有铁离子溶液显黄色,离子反应是:2Fe2+ + Cl2 === 2Fe3+ + 2Cl-;氧化产物中含有铁离子,可以用硫氰化钾溶液进行检验,如果溶液变为红色,证明有铁离子生成。
故答案为2Fe2+ + Cl2 === 2Fe3+ + 2Cl-;KSCN溶液;红色;
⑷铁离子在酸性条件下把二氧化硫氧化为硫酸根离子,本身还原为亚铁离子,可以说明氧化性Fe3+> SO2;离子方程式为:2Fe3++SO2 +2H2O === 2Fe2++SO42-+4H+;
故答案为2Fe3++SO2 +2H2O === 2Fe2++SO42-+4H+;
⑸甲选项,第一次有铁离子无亚铁离子,则氯气氧化性大于铁离子;甲中第二次含有硫酸根,可能是过量的氯气把二氧化硫氧化为硫酸根,不一定是铁离子把二氧化硫氧化所致,故甲错误;
乙选项,第一次既有铁离子又有亚铁离子,说明氯气不足,氯气氧化性大于铁离子;乙中第二次含有硫酸根,说明发生了二氧化硫与铁离子的反应,氧化性铁离子大于二氧化硫,因此可以证明氧化性:Cl2> Fe3+>SO2,故乙正确;
丙选项,第一次有铁离子无亚铁离子,则氯气氧化性大于铁离子;第二次有亚铁离子,说明发生了二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,因此可以证明氧化性:Cl2> Fe3+>SO2,故丙正确;
综上所述,答案为乙、丙。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的短周期主族元素,X、Y、Z分别为B、C、E对应的单质,甲、乙 、丙、丁为其中部分元素组成的化合物,其中C、D同主族,甲是一种能使湿润的红色石蕊试纸变蓝的气体,甲可用于检验Z气体是否泄漏。上述物质间的转化关系如图所示:

(1)B、C、D、E四种元素形成的简单离子中,离子半径由小到大的顺序是___(用化学用语表示)。
(2)下列事实能说明D元素的非金属性小于E的是___
a.对应氢化物的还原性:D>E
b.D和E两元素的简单氢化物受热分解,后者的分解温度高
c.单质的沸点:D>E
(3)已知元素Ts位于第七周期,与E同族,写出其中子数为176的核素符号___,预测Ts及其化合物最不可能具有的性质是___。
a.单质易溶于某些有机溶剂 b.单质是有色固体
c.氢化物很稳定 d.简单阴离子可与Ag+形成难溶物
(4)A、B两种元素可组成一种离子化合物BA5,该化合物的电子式为___。
(5)A、B、D三种元素组成离子化合物W,已知:
①1molW能与足量氢氧化钠溶液共热,生成22.4L气体(标准状况);
②W能与盐酸反应产生一种臭鸡蛋气味的气体。则W是___,写出①的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
(1)求x=__。
(2)求这段时间A的平均反应速率为___。
(3)平衡时B的浓度为___。
(4)A的转化率为___。
(5)下列叙述能说明上述反应达到平衡状态的是___。
A.单位时间内每消耗2molA,同时生成1molC
B.单位时间内每生成1molB,同时生成1molC
C.D的体积分数不再变化
D.恒容容器内混合气体的压强不再变化
E.B、C的浓度之比为1∶1
(6)某温度下在密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图,该反应的化学方程式是___。
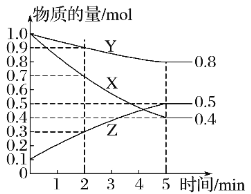
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
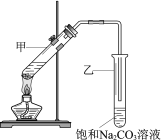
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:
![]() +2KMnO4
+2KMnO4 ![]() +KOH+2MnO2 +H2O
+KOH+2MnO2 +H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
下图回流搅拌装置
下图抽滤装置

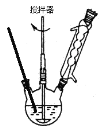
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
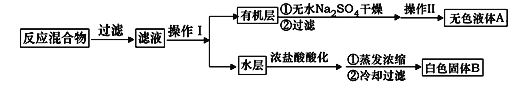
(1)无色液体A的结构简式为___________。操作Ⅱ为__________。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是______。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入__________,分液,水层再加入__________,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
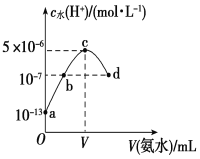
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
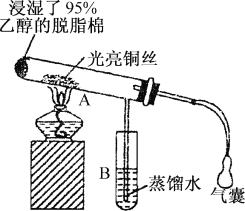
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com