
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
(1)求x=__。
(2)求这段时间A的平均反应速率为___。
(3)平衡时B的浓度为___。
(4)A的转化率为___。
(5)下列叙述能说明上述反应达到平衡状态的是___。
A.单位时间内每消耗2molA,同时生成1molC
B.单位时间内每生成1molB,同时生成1molC
C.D的体积分数不再变化
D.恒容容器内混合气体的压强不再变化
E.B、C的浓度之比为1∶1
(6)某温度下在密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图,该反应的化学方程式是___。
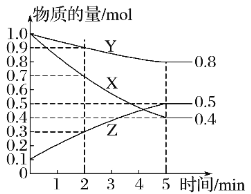
【答案】2 0.2mol·L-1·s-1 1mol·L-1 50% BC 3X+Y![]() 2Z
2Z
【解析】
根据题干信息可建立“三段式”:
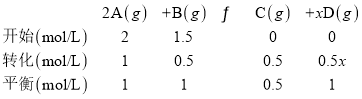
据此进行分析计算;
(1)根据“三段式”,0.5x=1,则x=2;
(2)这段时间A的平均反应速率为![]() 0.2mol·L-1·s-1 ;
0.2mol·L-1·s-1 ;
(3)根据“三段式”,平衡时B的浓度为1mol·L-1;
(4)根据“三段式”,A的转化率为![]() 50%;
50%;
(5)A.单位时间内每消耗2molA,同时生成1molC,不能判断正逆反应速率是否相等,故不选A;
B.单位时间内每生成1molB,同时生成1molC,可知正逆反应速率相等,反应一定达到平衡状态,故选B;
C.反应达到平衡时,各物质百分含量不变,若D的体积分数不再变化,反应一定平衡,故选C;
D.2A(g)+B(g)![]() C(g)+2D(g),反应前后气体物质的量不变,恒容容器内混合气体的压强是恒量,压强不再变化,不一定平衡,故不选D;
C(g)+2D(g),反应前后气体物质的量不变,恒容容器内混合气体的压强是恒量,压强不再变化,不一定平衡,故不选D;
E.B、C的浓度之比为1∶1,不一定不再变化,反应不一定平衡,故不选E;
选BC;
(6)X、Y物质的量减少,X、Y是反应物,Z物质的量增多,Z是生成物,X、Y、Z的变化量分别为0.6mol、0.2mol、0.4mol,变化量比等于系数比,该反应的化学方程式是3X+Y![]() 2Z。
2Z。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图:
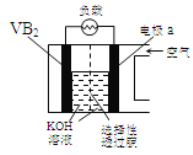
该电池工作时反应为:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列说法正确的是
A.VB2极发生的电极反应为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.电极a为电池负极
C.电流由VB2极经负载流向电极a
D.图中选择性透过膜允许阳离子选择性透过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度是1.16 g·L1,B的产量可以用来衡量一个国家石油化工发展水平,G是一种高分子化合物。现有 A、B、C、D、E、F、G 存在如下关系:
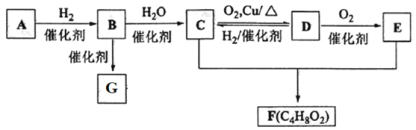
请回答:
(1)D中的官能团名称是_______________。 B的结构式为_________;
(2)写出 C+E→F反应的化学方程式__________;
(3)写出 C→D反应的化学方程式为__________;
(4)已知三分子 A 在一定条件下可合成不能使酸性 KMnO4 溶液褪色的有机物,写出该合成反应的化学方程式___________,反应类型为___________。
(5)下列有关叙述正确的是_____________。
a. A、B、C、D、E、F、G均为非电解质
b. A中所有原子不可能处于同一平面上
c. 加热时,D 能与新制氢氧化铜悬浊液反应生成砖红色沉淀
d.75%(体积分数)的 C 水溶液常用于医疗消毒
e. 将绿豆大小的钠块投入 C 中,钠块浮于液面上,并有大量气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
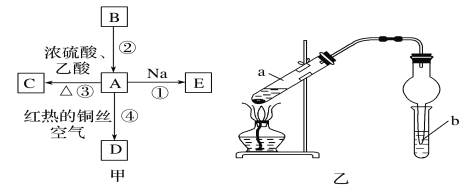
(1)C的结构简式__;A中官能团的名称为__。
(2)写出下列反应的化学方程式:
反应①__;
反应④__。
(3)实验室利用反应③制取C,常用图乙装置:
①a试管中主要反应的化学方程式为__。反应类型是__。
②在实验中用到了:铁架台(铁夹),酒精灯,试管,导管(橡胶管)和__。(填仪器名称)
③试管b中溶液名称为__,实验后观察到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2 > Fe3+ >SO2,某化学研究性学习小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
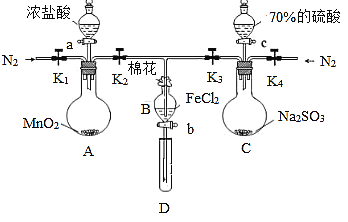
Ⅰ.打开弹簧夹K1—K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
回答下列问题:
(1)过程Ⅰ的目的是________。
(2)棉花中浸润的溶液为________,作用是_____________。
(3)导致步骤Ⅲ中溶液变黄的离子反应是____,用_____,(写试剂化学式)检验氧化产物,现象是____。
(4)能说明氧化性Fe3+>SO2的离子方程式是________。
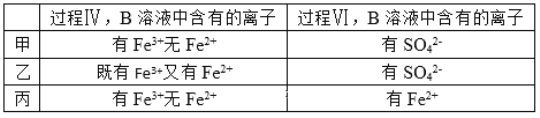
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2> Fe3+>SO2的是__(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L四氯化碳分子数为NA
B. 常温下,16gO2和O3组成的混合气体中所含有的原子数为NA
C. 常温下,1mol/L的AlCl3溶液中含有的Cl-离子数为3NA
D. 18gNH4+离子中所含的电子总数为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com