
【题目】氨能源的循环利用是目前研究的热点之一。
(1)一种可以快速启动的氨制氢工艺如图a所示:
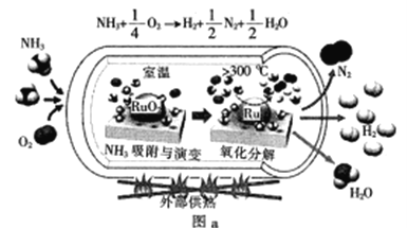
已知:![]()
![]()
快速制氢反应:![]() 的
的![]() =__
=__![]()
(2)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:
c(NH3)/mol/L | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为_________:c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=_____________ (保留三位有效数字)mol·L-1·S-1。
(3)在101kPa下,NH3分解的平衡转化率与温度的关系如图b所示:
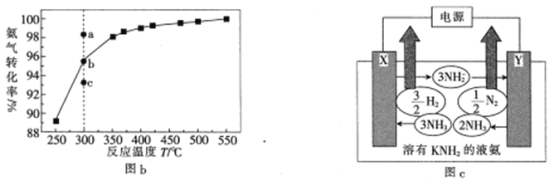
①温度为300℃,总压为101kPa时,图b中v(正)>v(逆)的点是_____(填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有_____________________________
(4)已知液氮中存在下列平衡:2NH3(l)![]() NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
①电极X的名称是__________________(填“阳极”或“阴极”)。
②图c中阳极的电极反应式为______________________________________________
③若图c中支持电解质改用NH4Cl,则阴极的电极反应式为__________________________
【答案】—75.4 825 7.77×10—6 c 使用合适催化剂 阴极 6NH2-—6e—= N2↑+4NH3 2NH4++2e—= H2↑+2NH3
【解析】
(1)由盖斯定律计算可得;
(2)由表格数据可知,当氨气浓度减小一半所需时间的增加值为440、440×![]() 、440×
、440×![]() ×
×![]() 、440×
、440×![]() ×
×![]() ×
×![]() 。。。;先计算氨气速率,再依据化学方程式计算氢气速率;c点反应为达到平衡,是平衡的形成过程;
。。。;先计算氨气速率,再依据化学方程式计算氢气速率;c点反应为达到平衡,是平衡的形成过程;
②催化剂能够降低反应的活化能;
(4)①由图可知,X极上NH3得电子发生还原反应生成H2和NH2-;
②由图可知,阳极Y极上NH2-失电子发生氧化反应生成N2和NH3;
③若图c中支持电解质改用NH4Cl,阴极上NH4+得电子发生还原反应生成H2和NH3。
(3)①由图可知,温度为300℃,总压为101kPa时,图b中b点为平衡点,
(1)将已知反应依次编号为①②,由盖斯定律可知![]() ×①+
×①+![]() ×②可得快速制氢反应
×②可得快速制氢反应![]() ,则
,则![]() =
=![]() ×(+45.9kJ/mol)+
×(+45.9kJ/mol)+![]() ×(—318 kJ/mol)=—75.4 kJ/mol,故答案为:—75.4;
×(—318 kJ/mol)=—75.4 kJ/mol,故答案为:—75.4;
(2)由表格数据可知,当氨气浓度减小一半所需时间的增加值为440、440×![]() 、440×
、440×![]() ×
×![]() 、440×
、440×![]() ×
×![]() ×
×![]() ,则t5=770+440×
,则t5=770+440×![]() ×
×![]() ×
×![]() =825;c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=
=825;c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=![]() v(NH3)=
v(NH3)=![]() ×
×![]() =7.77×10—6mol·L-1·S-1,故答案为:825;7.77×10—6;
=7.77×10—6mol·L-1·S-1,故答案为:825;7.77×10—6;
(3)①由图可知,温度为300℃,总压为101kPa时,图b中b点为平衡点,v(正)=v(逆),c点反应为达到平衡,v(正)>v(逆),故答案为:c;
②催化剂能够降低反应的活化能,则为降低NH3分解的活化能的措施为使用催化剂,故答案为:使用合适催化剂;
(4)①由图可知,X极上NH3得电子发生还原反应生成H2和NH2-,则X极为电解池的阴极,故答案为:阴极;
②由图可知,阳极Y极上NH2-失电子发生氧化反应生成N2和NH3,电极反应式为6NH2-—6e—= N2↑+4NH3,故答案为:6NH2-—6e—= N2↑+4NH3;
③若图c中支持电解质改用NH4Cl,阴极上NH4+得电子发生还原反应生成H2和NH3,电极反应式为2NH4++2e—= H2↑+2NH3,故答案为:2NH4++2e—= H2↑+2NH3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是
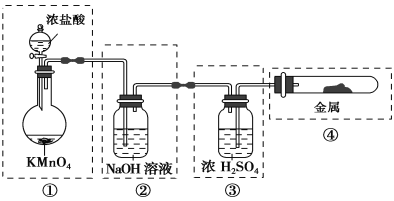
A. ①和②B. ②C. ②和③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
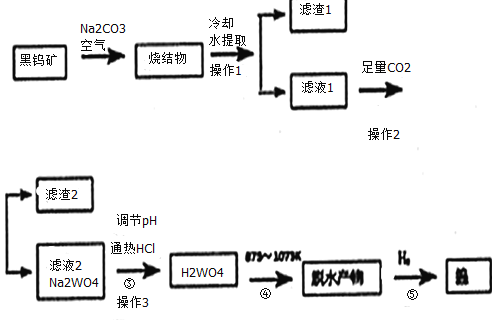
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A. 洗气瓶中产生的沉淀是碳酸钡B. 洗气瓶中产生的沉淀是亚硫酸钡
C. 在Z导管出来的气体中没有二氧化碳D. 在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
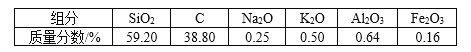
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 0.5 mol苯分子中含有C=C双键数为1.5 NA
B. 1 mol甲基(﹣CH3)所含的电子总数为10 NA
C. 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为![]() NA
NA
D. 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是是由裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
下图是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
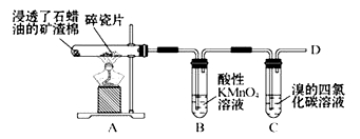
(1)A中碎瓷片的作用是 。
(2)B中反应类型是 。C中实验现象是 。
II.现有CH4、C2H4、C6H6三种有机化合物:
(3)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。生成二氧化碳最多的是__________,生成水最多的是_________。
III.(4)分子式为C9H12的苯的同系物有 种,若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为 。
(5)分子中含有22 个共价键的烷烃,烷烃的分子式: 。
(6)支链只有一个乙基且式量最小的烷烃的结构简式 ,其名称为 。
(7)将某种烷烃进行氯代反应,测出一氯代物有4 种。3.6g 该烃完全生成一氯代物时,放出的气体用蒸馏水完全吸收,所得溶液用0.1 mol·L-1NaOH 溶液500mL恰好中和。则此烷烃的分子式为 ,其结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知O2F2可以发生反应:H2S+4O2F2 = SF6+2HF+4O2,下列说法正确的是( )
A.SF6是还原产物
B.O2F2是还原剂
C.若生成3.2g O2,则转移0.2 mol e
D.还原剂与氧化剂的物质的量之比为4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1molNaBH4与足量水反应生成NaBO2和H2时转移的电子数为4NA
C.25℃,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
D.相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com