
【题目】31.04gFe3O4、Fe2O3、FeO组成的固体混合物,用180 mL6.0 mol·L-1盐酸能恰好将之完全溶解。若将此固体混合物用CO完全还原,则生成的铁的物质的量为
A.0.2molB.0.3molC.0.4molD.0.5mol
【答案】C
【解析】
Fe3O4、Fe2O3、FeO组成的固体混合物用CO还原,CO夺取混合物中的氧,生成Fe的质量=混合物总质量-减去混合物中氧元素质量,进而计算Fe的物质的量。而混合物用盐酸能恰好将之完全溶解,混合物中氧与氯化氢中的氢结合生成水,由O原子、H原子守恒可知n(O)=n(H2O)=![]() n(HCl),可得混合物中氧元素质量。
n(HCl),可得混合物中氧元素质量。
混合物用盐酸能恰好将之完全溶解,混合物中氧与氯化氢中的氢结合生成水,由O原子、H原子守恒可知n(O)=n(H2O)= ![]() n(HCl)=
n(HCl)=![]() ×0.18L×6.0mol/L=0.54mol,故生成Fe的质量=31.04g-0.54mol×16g/mol=22.4g,故n(Fe)=
×0.18L×6.0mol/L=0.54mol,故生成Fe的质量=31.04g-0.54mol×16g/mol=22.4g,故n(Fe)=![]() =0.4mol;故选:C。
=0.4mol;故选:C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
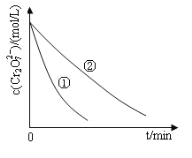
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是
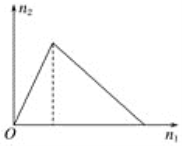
A. X为氢氧化钠,Y为氯化铝
B. X为氯化铝,Y为氢氧化钠
C. X为盐酸,Y为四羟基合铝酸钠
D. X为四羟基合铝酸钠,Y为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
B. 充电时阳极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com