
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
【答案】H2S Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O SO3+2OH=SO42+H2O B 2∶1
CuSO4+SO2↑+2H2O SO3+2OH=SO42+H2O B 2∶1
【解析】
(1)根据图象化合价和物质分类可知,X为-2价硫元素的氧化物,化学式为H2S;
(2)H2SO4的浓溶液与铜单质在加热条件下可以发生化学反应生成硫酸铜,二氧化硫,和水;
(3)酸性氧化物和碱反应生成盐和水,离子方程式为SO3+2OH=SO42+H2O;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于+2和小于+2;
(5)在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;H2S中S元素的化合价由-2升高到0,为还原剂,则S单质既是氧化产物又是还原产物,由S原子守恒及反应可知,2mol还原剂反应生成氧化产物为2mol,1mol氧化剂反应生成还原产物为1mol,因为氧化产物与还原产物均为S,所以质量之比等于物质的量之比为2:1。
(1)根据图象化合价和物质分类可知,X为-2价硫元素的氧化物,化学式为H2S;
正确答案:H2S
(2)H2SO4的浓溶液与铜单质在加热条件下可以发生化学反应生成硫酸铜,二氧化硫,和水,方程式Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
正确答案:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(3)酸性氧化物和碱反应生成盐和水,离子方程式为SO3+2OH=SO42+H2O;
正确答案:SO3+2OH=SO42+H2O。
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于+2和小于+2;
A.硫元素的化合价都低于+2价,故A不正确;
B.硫元素的化合价分别大于+2和小于+2,故B正确;
C.硫元素的化合价都高于+2价,故C不正确;
D.硫元素的化合价都高于+2价,故D不正确;
正确答案:B。
(5)在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;H2S中S元素的化合价由-2升高到0,为还原剂,则S单质既是氧化产物又是还原产物,由S原子守恒及反应可知,2mol还原剂反应生成氧化产物为2mol,1mol氧化剂反应生成还原产物为1mol,因为氧化产物与还原产物均为S,所以质量之比等于物质的量之比为2:1;
正确答案:2∶1。


科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )

A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
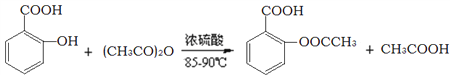
【题目】阿司匹林的有效成分是乙酰水杨酸(![]() )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
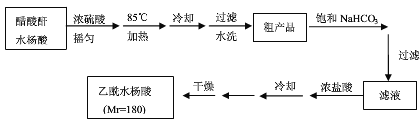
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是______________。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式______。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是_______________________________。判断该过程结束的方法是__________________________________。
② 滤液缓慢加入浓盐酸中,看到的现象是_______________________。
③ 检验最终产品中是否含有水杨酸的化学方法是_________________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式_________________。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铬的水合物为CrCl3·6H2O,其中铬元素的配位数是6,将含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,则氯化铬溶于水中的含铬阳离子为
A. Cr3+B. [CrCl2(H2O)4]+C. [CrCl(H2O)5]2+D. [Cr(H2O)6]3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是 ( )
A. 石油裂化主要得到乙烯
B. 石油分馏是化学变化,可得到汽油、煤油
C. 煤干馏主要得到焦炭、煤焦油、粗氨水、粗苯和焦炉气
D. 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-l B. v(A2)=30 mol·L-1·min-l
C. v(AB3)=1.0 mol·L-1·s-l D. v(B2)=1.2 mol·L-1·s-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物说法正确的是( )
A. 硅是非金属单质,与任何酸都不发生反应
B. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C. NaOH溶液保存在磨口玻璃塞的试剂瓶中
D. 可利用HCl除去SiO2中的少量CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com