
【题目】下列关于硅及其化合物说法正确的是( )
A. 硅是非金属单质,与任何酸都不发生反应
B. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C. NaOH溶液保存在磨口玻璃塞的试剂瓶中
D. 可利用HCl除去SiO2中的少量CaCO3
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量W和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的物质的量之比为

A. 1∶1 B. 2∶3 C. 8∶9 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代有“女蜗补天”的传说,今天人类也面临“补天”的问题,下列采取的措施与今天所说的“补天”无关的是
A. 禁止使用含氟电冰箱
B. 倡导使用无磷洗衣粉
C. 硝酸厂的尾气按相关规定处理
D. 研究新型催化剂,消除汽车尾气的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为 71 ℃,不溶于冷水,易溶于有机溶剂,密度为 1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃ 爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-________-________-2-3-6-7-________-________-____。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为____________________。
(3)A装置中发生反应的离子方程式为_________________________________________。
(4)B装置中发生反应的化学方程式为___________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 __________________。
(5)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,结合反应方程式解释该现象: _____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素的负一价离子的最外层电子数与次外层的相同。F元素原子的价电子数比其余电子数少8。
(1)A、C、D的第一电离能由大到小的顺序为_____________(用元素符号表示),F在元素周期表中的位置__________。
(2)B、D形成的化合物中属于非极性分子的是_______(填化学式)。
(3)B、C形成的某种化合物结构如图所示,该结构中C-B键的键长有两类,键长较短的键为_______________(填图中字母a或b),1mol该分子中含有的σ键数目为________。C、E形成某化合物,其分子中所有原子的最外层均为8电子稳定结构,该化合物的电子式为________。
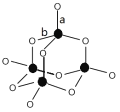
(4)元素E的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(5)F可与CO形成羰基配合物F2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①F2(CO)8为_________晶体(填晶体类型)。
②F2(CO)8晶体中存在的作用力有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com