
����Ŀ����1��NA��ʾ�����ӵ���������ֵ��46g NO2��N2O4�Ļ�������к���_____NA����ԭ�ӣ�2L0.6 mol��L1 Fe(NO3)3��Һ�к�_____NA��NO3�����ӣ�
��2����������(NF3)��һ�����壬�������ӹ�ҵ�����Ĺؼ�ԭ��֮һ�����������ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3��
��д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________
�������������ɰ����ͷ�����Ӧ�õ���4NH3+3F2NF3+3NH4F���������Ʋ�NF3��F2��NO���������У���������ǿ������˳��Ϊ________________________
��3��H2C2O4��Һ��KMnO4������Һ�ɷ�����Ӧ��___H2C2O4+___MnO4��+___H+��___CO2��+___Mn2++___H2O����Ӧ��ÿ���ɱ����4.48L CO2���壬���·��ͨ���ĵ��ӵ����ʵ���Ϊ___________mol��
��4������������N2H4���ǵ������ֳ���������Ʊ��������ñ�ͪΪ�����������������백����Ӧ���÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ2��1��д���÷�Ӧ�Ļ�ѧ����ʽ_______��
���𰸡�23.63NF3+5H2O===2NO+HNO3+9HFF2��NF3��NO52610280.2NaClO+2NH3===N2H4+H2O+NaCl
��������
��1��NO2��N2O4�����ʽ��ͬ��NA��ʾ�����ӵ���������ֵ��46g NO2��N2O4�Ļ�������к�����ԭ��=![]() ��2��NA/mol=2NA��2L 0.6mol/L Fe��NO3��3��Һ�к����������=2L��0.6mol/L��3��NA/mol=3.6NA���ʴ�Ϊ��2��3.6����2�������������ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3��NԪ�ػ��ϼ���+3�۱�Ϊ+2�ۡ�+5�ۣ��ɵ��ӡ�ԭ���غ��֪��ӦΪ��3NF3+5H2O�T2NO+HNO3+9HF����4NH3+3F2=NF3+3NH4F�У�FԪ�صĻ��ϼ۽��ͣ�F2Ϊ���������������������Դ�����������������ԣ���������ΪF2��NF3����Ϣ��з�����֪����������ǿ����˳��ΪF2��NF3��NO����3��H2C2O4��CԪ�صĻ��ϼ�Ϊ+3�ۣ�������̼������C�Ļ��ϼ�Ϊ+4�ۣ����ϼ���������2�ۣ�MnO4����MnԪ�صĻ��ϼ�Ϊ+7����Ӧ���Ϊ+2�۵�Mn2+�����ϼ۽���5�ۣ����ϼ۱仯����С������Ϊ10����MnO4����ϵ��Ϊ2��H2C2O4��ϵ��Ϊ5��Ȼ�����ù۲취��ƽΪ��5H2C2O4+2MnO4��+6H+=10CO2+2Mn2++8H2O����״����4.48L������̼�����ʵ���Ϊ��
��2��NA/mol=2NA��2L 0.6mol/L Fe��NO3��3��Һ�к����������=2L��0.6mol/L��3��NA/mol=3.6NA���ʴ�Ϊ��2��3.6����2�������������ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3��NԪ�ػ��ϼ���+3�۱�Ϊ+2�ۡ�+5�ۣ��ɵ��ӡ�ԭ���غ��֪��ӦΪ��3NF3+5H2O�T2NO+HNO3+9HF����4NH3+3F2=NF3+3NH4F�У�FԪ�صĻ��ϼ۽��ͣ�F2Ϊ���������������������Դ�����������������ԣ���������ΪF2��NF3����Ϣ��з�����֪����������ǿ����˳��ΪF2��NF3��NO����3��H2C2O4��CԪ�صĻ��ϼ�Ϊ+3�ۣ�������̼������C�Ļ��ϼ�Ϊ+4�ۣ����ϼ���������2�ۣ�MnO4����MnԪ�صĻ��ϼ�Ϊ+7����Ӧ���Ϊ+2�۵�Mn2+�����ϼ۽���5�ۣ����ϼ۱仯����С������Ϊ10����MnO4����ϵ��Ϊ2��H2C2O4��ϵ��Ϊ5��Ȼ�����ù۲취��ƽΪ��5H2C2O4+2MnO4��+6H+=10CO2+2Mn2++8H2O����״����4.48L������̼�����ʵ���Ϊ��![]() =0.2mol��H2C2O4��CԪ�صĻ��ϼ�Ϊ+3�ۣ�������̼������C�Ļ��ϼ�Ϊ+4�ۣ�������0.2mol������̼ת�Ƶĵ��ӵ����ʵ���Ϊ��0.2mol����4��3��=0.2mol���ʴ�Ϊ��5��2��6��10��2��8��0.2��
=0.2mol��H2C2O4��CԪ�صĻ��ϼ�Ϊ+3�ۣ�������̼������C�Ļ��ϼ�Ϊ+4�ۣ�������0.2mol������̼ת�Ƶĵ��ӵ����ʵ���Ϊ��0.2mol����4��3��=0.2mol���ʴ�Ϊ��5��2��6��10��2��8��0.2��
��4���Ʊ��µķ���������NaClO����NH3����Ӧ�л�ԭ���������������ʵ���֮��Ϊ2��1���Ƶ��µ�ϡ��Һ����Ӧ����ʽΪ��NaClO+2NH3�TN2H4+H2O+NaCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֳ����ĵ��ʣ��ҡ���Ϊ��ѧ�����Ļ�����ס��ҡ���������Ԫ�� X �����������µ�ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ����:
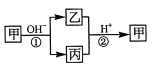
A�� XԪ�ؿ���ΪAl B�� X Ԫ�ز�һ��Ϊ�ǽ���Ԫ��
C����Ӧ��������Ϊ���淴Ӧ D����Ӧ������һ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ̼��������ᷴӦ��CO32����2H��![]() CO2����H2O
CO2����H2O
B. �Ȼ�����Һ�м��������ˮ��Al3++3NH3��H2O![]() Al(OH)3��+3NH4+
Al(OH)3��+3NH4+
C. ���������������Һ��Ӧ��Ba2����SO42��![]() BaSO4��
BaSO4��
D. ������������ͭ��Һ�У�2Fe��3Cu2��![]() 2Fe3����3Cu
2Fe3����3Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���͵�أ���NaBH4��B�Ļ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϣ��������ϲ���Pt���������ϲ���MnO2�������缫�����ֶԸü��ĵ缫��Ӧ���д����ã����õ�ؿ��������ǡ���ˮ��̽������������Դ���乤��ԭ����ͼ��ʾ������˵������ȷ����

A. ÿ����3mol H2O2��ת��6mol e��
B. ��ع���ʱNa+��b��������a����
C. a���ϵĵ缫��ӦʽΪ��BH4��+8OH����8e���TBO2��+6H2O
D. b��������MnO2���õ���ܷ�Ӧ����ʽ��NaBH4 + 4H2O2===NaBO2 + 6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������98%Ũ���ᣨ�ܶ�1.84 g��cm3������Ũ��Ϊ0.5 mol��L1ϡ����500mL��
��1��ѡ�õ���Ҫ�����У�_________��________��__________��_______��
__________��
��2���뽫���в���������ȷ��������ں�����___
A������Ͳ��ȡŨ����
B�������ߵ�ҡ��
C���ý���ιܼ�ˮ���̶�
D��ϴ���ձ��ڱںͲ�����������ϴҺת������ƿ
E��ϡ��Ũ����
F������Һת������ƿ
��3������Ũ��������Ϊ______mL��
��4����Ũ���������ձ��ڱ�����ע��ʢˮ���ձ��У����Ͻ����Ŀ����______���������������Һ�彦������ʹ���ս��______����ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ����������������������������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е���������
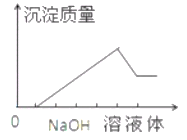
A. Mg2+��Al3+��Fe3+ B. H+��Mg2+��Al3+
C. H+��Ba2+��Al3+ D. ֻ��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ�ݵĸ��ֻ�ѧԪ�غͻ������У�ռϸ����������Ԫ�غͻ�����ֱ��ǣ� ��
A.H��ˮB.C��������C.N��������D.O��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ�����ȷ���ǣ� ��
A.����ȡ�ķ�����ȥ�������е�ˮ��
B.�ù��˵ķ�����ȥNaCl��Һ�к��е�����KNO3
C.�þƾ���ȡ��ˮ�еĵ�
D.������ķ�����ȥˮ�еIJ��ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йغ���(����Ǧ)�Ľ�����ȷ���ǣ� ��
A.�������۵������Ǧ���۵��
B.�������۵�������ӵ��۵��
C.�������۵���������۵��
D.�������۵��Ǧ�������۵㶼��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com