
【题目】下列离子方程式书写正确的是
A. 碳酸钙与盐酸反应:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
B. 氯化铝溶液中加入过量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
C. 硫酸和氢氧化钡溶液反应:Ba2++SO42-![]() BaSO4↓
BaSO4↓
D. 铁钉放入硫酸铜溶液中:2Fe+3Cu2+![]() 2Fe3++3Cu
2Fe3++3Cu
科目:高中化学 来源: 题型:
【题目】组成人体细胞的主要元素是( )
A. C、H、O、N、Ca、PB. H、O、K、S、P、Mg
C. C、P、O、S、H、ND. N、P、K、Ca、S、Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲.乙.丙.丁四种晶胞(如下图所示),可推知:甲晶体中A与B的离子个数比为________;乙晶体的化学式为_________;丙晶体的化学式为__________;丁晶体的化学式为________。
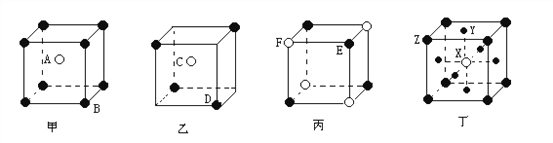
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C;B溶液和C溶液混合可生成A。请回答:
(1)B是___________,D是___________,(均用化学式表示)
(2)写出上述反应中由A生成C的化学方程式:____________________________________。
II.化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:
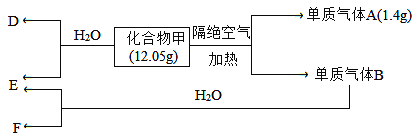
请回答:
(1)化合物甲所含元素为__________(填写元素符号),甲的化学式为___________________。
(2)气体B与水反应的离子方程式为____________________________________。
(3)甲与水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值下列有关叙述正确的是
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
C. 0.1 mol![]() Sr原子中含中子数为3.8NA
Sr原子中含中子数为3.8NA
D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
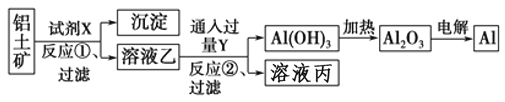
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是将Fe2+氧化为Fe3+ ,其离子方程式________________________,还可使用双氧水代替硝酸,其优点是_________________________________________。
(2)沉淀B的主要成分是_____、_______,往沉淀B中加入足量氢氧化钠溶液,现象是_________,该反应的离子方程式为____________________________________。
(3)加氨水过程需控制溶液的pH值,如何用pH试纸测定溶液的pH值___________。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:2![]() +6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com