
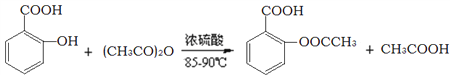
【题目】阿司匹林的有效成分是乙酰水杨酸(![]() )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
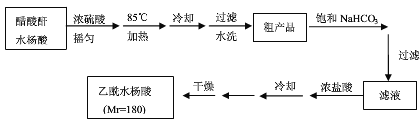
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是______________。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式______。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是_______________________________。判断该过程结束的方法是__________________________________。
② 滤液缓慢加入浓盐酸中,看到的现象是_______________________。
③ 检验最终产品中是否含有水杨酸的化学方法是_________________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式_________________。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为_____________________________。
【答案】 水浴加热  使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离 无气泡产生 有浑浊产生 取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸
使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离 无气泡产生 有浑浊产生 取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸 ![]() +3NaOH
+3NaOH![]() CH3COONa+2H2O+
CH3COONa+2H2O+![]() 0.060 (aV1-bV2) /m
0.060 (aV1-bV2) /m
【解析】试题分析:(1)因为加热温度低于水的沸点,所以用水浴加热的方法;(2)水杨酸中含有酚羟基和羧基,可发生自身的缩聚反应,得到聚合物: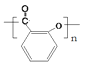 ;因为水杨酸钠应溶于水,便于分离;且当不再产生气体时,判断过程结束;当加入盐酸会转化为微溶于水的水杨酸,所以产生浑浊;检验水杨酸可检验酚羟基。(4)判断过量的NaOH的物质的量为:bV2×10-3mol,则乙酰水杨酸消耗的NaOH的物质的量为:(aV1×10-3-bV2×10-3)mol,乙酰水杨酸的质量为1/3×(aV1×10-3-bV2×10-3)mol×180g/mol=1/3×(aV1-bV2)×0.18,从而求得其质量分数。
;因为水杨酸钠应溶于水,便于分离;且当不再产生气体时,判断过程结束;当加入盐酸会转化为微溶于水的水杨酸,所以产生浑浊;检验水杨酸可检验酚羟基。(4)判断过量的NaOH的物质的量为:bV2×10-3mol,则乙酰水杨酸消耗的NaOH的物质的量为:(aV1×10-3-bV2×10-3)mol,乙酰水杨酸的质量为1/3×(aV1×10-3-bV2×10-3)mol×180g/mol=1/3×(aV1-bV2)×0.18,从而求得其质量分数。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】有机物A可用作果实催熟剂。某同学欲以A为主要原料合成乙酸乙酯,其合成路线如下图所示。请回答:
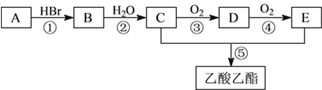
(1)C分子中官能团的电子式是_______________;C的同分异构体F的核磁共振氢谱中,只有一种类型氢原子的吸收峰,F的结构简式是___________。
(2)反应②的化学方程式是__________________________________;反应⑤的化学方程式是__________________________________;
(3)为了检验B中的溴元素,以下操作合理的顺序是_______________(填序号)。
a.加AgNO3溶液 b.加NaOH 溶液 c.加热 d.加稀硝酸至溶液显酸性
(4)实验室制A的化学方程式:__________________________________;在制备中产生SO2会干扰A性质验证,写出SO2与溴水反应的离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有色透明溶液中,一定能大量共存的是( )
A.含有0.1mol/L Ba2+的溶液中:Na+、K+、HCO3-、Cl-
B.在氨水中:K+、Cu2+、Cl-、SO42-
C.强酸性溶液中:Fe3+、MnO4-、SO42-、K+
D.强酸性溶液中:Na+、Fe2+、Cr2O72-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1molA水解得到1molB和1mol醋酸,A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素的质量分数和为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是
A. A、B的相对分子质量之差为42
B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3
D. B能与NaOH溶液、FeCl3溶液等物质反应,但不与溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:

现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
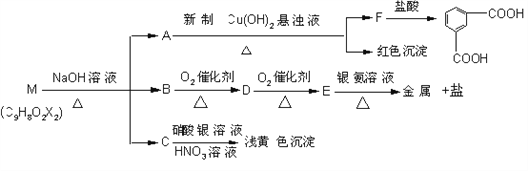
试回答下列问题:
(1)X为____________________(填元素符号);
(2)上述转化中其中属于氧化反应的共有_______步(填数字);M与NaOH溶液共热反应的所属类型是_______________ 反应。
(3)M的结构简式为 ________________________________
(4)写出下列反应的化学方程:
E和银氨溶液反应的化学方程式:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入H2O2,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________;加入H2O2的主要目的是_______________________________。
③若要检验溶液中的Fe3+,则应该加入________________试剂。
④步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com