
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、对“地沟油”进行分馏可得到汽油 |
| B、向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C、误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
| D、PM2.5二氧化碳都属于空气质量日报的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
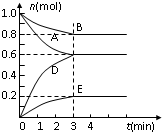 T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:| 物质 | A | B | D | E |
| 物质的量mol | 0.8 | 1.0 | 0.4 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
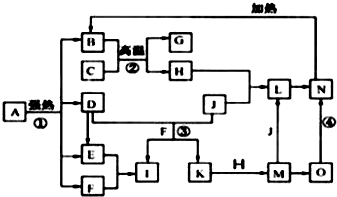
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| c(CH3COOH) |
| c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
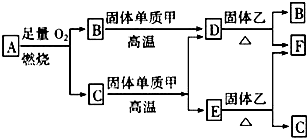
查看答案和解析>>
科目:高中化学 来源: 题型:
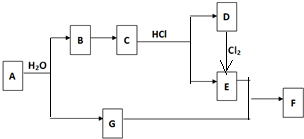
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com