
根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① |
| FeBr2 | / |
| Cl- |
② | MnO2 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:MnO2>Fe3+>Cl2>Br2
C.表中②组反应的氧化产物是MnCl2,1molMnO2电子转移数目是2NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
A
【解析】
试题分析:A.由于还原剂为FeBr2,还原产物是Cl-,所以氧化剂为Cl2,由于氧化性Cl2>Br2> Fe3+.所以若通入的氯气少量,发生的反应是2Fe2++Cl2= 2Cl-+2Fe3+;若氯气足量,发生的反应是2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2,表中①组的反应可能有一种或两种元素被氧化。正确。B.在加热时发生反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;氧化性MnO2> Cl2;2Fe2++Cl2= 2Cl-+2Fe3+;氧化性 Cl2>Fe3+;发生反应Cl2+2NaBr=2NaCl+Br2 ,氧化性Cl2>Br2,发生反应:2Fe2++Br2= 2Br-+2Fe3+ 氧化性Br2> Fe3+;错误。C.表中②组反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;氧化性MnO2> Cl2;2Fe2++Cl2= 2Cl-+2Fe3+;氧化性 Cl2>Fe3+;发生反应Cl2+2NaBr=2NaCl+Br2 ,氧化性Cl2>Br2,发生反应:2Fe2++Br2= 2Br-+2Fe3+ 氧化性Br2> Fe3+;错误。C.表中②组反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O的氧化产物是Cl2,1molMnO2电子转移数目是2NA。错误。D.表中③组反应的离子方程式为:2MnO4—+5H2O2+ 6H+= 2Mn2++5O2↑+8H2O.电子不守恒.错误.
MnCl2+Cl2↑+2H2O的氧化产物是Cl2,1molMnO2电子转移数目是2NA。错误。D.表中③组反应的离子方程式为:2MnO4—+5H2O2+ 6H+= 2Mn2++5O2↑+8H2O.电子不守恒.错误.
考点:考查关于氧化还原反应的概念、电子守恒及离子方程式的书写的知识。


科目:高中化学 来源:2015届浙江省协作体高考摸底测试理科综合化学试卷(解析版) 题型:填空题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
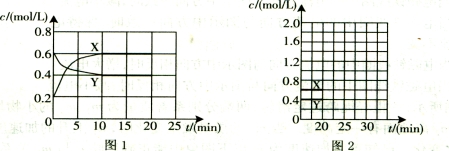
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)=0.9 mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
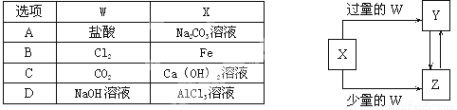
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.CO2分子比例模型: B.NH4I的电子式:
B.NH4I的电子式: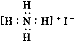
C.乙烯的结构简式 C2H4 D.NaH中氢离子结构示意图为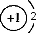
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区六校高二下学期期中联考化学试卷(解析版) 题型:填空题
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 (填物质的化学式)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时) 、 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是 。
A.Au B.Cu C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
① ,②Na2CO3,③ ,④NaHCO3。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区六校高二下学期期中联考化学试卷(解析版) 题型:选择题
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区六校高二下学期期中联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数。下列叙述正确的是
A.常温常压下,22 g CO2中含有NA个C=O键
B.标准状况下,将22.4L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.9 g重水含有的电子数为5 NA
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中化学试卷(解析版) 题型:选择题
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示。下列说法正确的是
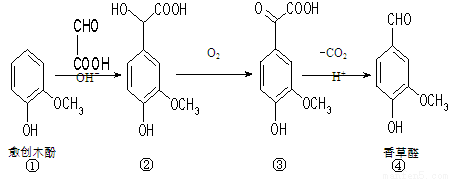
A.在上述三步反应中理论上只有①生成②的反应原子利用率为100%
B.氯化铁溶液和碳酸氢钠溶液都能鉴别③④
C.②分子中C原子不可能在同一平面上
D.等物质的量的①②分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:实验题
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为主要原料制备环己烯。
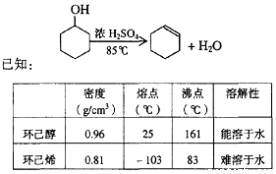
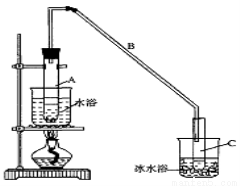
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
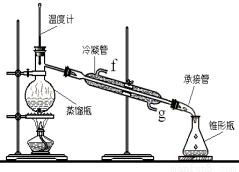
②再将环己烯按下图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com