


科目:高中化学 来源: 题型:
| A、平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动 |
| B、当混合气体的物质的量不再改变时,反应达到平衡状态 |
| C、平衡后保持其它条件不变,升高温度和加入催化剂,SO2的转化率均增大 |
| D、反应前2min的平均速率v(SO2)=0.1a mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )| A、HA是一种强酸 |
| B、x点,[A-]=[B-] |
| C、HB是一种弱酸 |
| D、原溶液中HA的物质的量浓度为HB的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
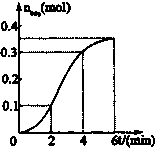 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A、反应开始后2~4分钟内平均反应速率最大 |
| B、反应刚开始时反应速率较小,然后逐渐增大 |
| C、反应前阶段速率逐渐增大,是因为反应放热,使反应速率加快 |
| D、生成物CaCl2、CO2和H2O的总能量比反应物CaCO3和盐酸的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件① |
| 条件② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com