
【题目】下列说法正确的是:
A. 工业上冶炼铁加入焦炭,目的是利用炭将金属铁从氧化物中还原出来
B. 工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅
C. 工业上用金属钠与TiCl4溶液在高温下反应,目的是将金属钛从氯化物中置换出来
D. 海水中提取镁的过程中加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2
【答案】D
【解析】
A. 工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来,因此工业上冶炼铁加入焦炭的目的是利用炭产生CO,同时提供反应所需要的热量,故A错误;
B. 炼铁材料为铁矿石、焦炭、石灰石,加入石灰石,目的是除去杂质二氧化硅,普通玻璃的原料有石英、石灰石和纯碱,石灰石是制玻璃的原料之一,故B错误;
C. 钠与TiCl4溶液中的水发生反应,不能将金属钛从氯化物溶液中置换出来,工业上用金属钠与TiCl4熔融液在高温下反应,将金属钛从氯化物中置换出来,故C错误;
D. 把贝壳制成石灰乳[Ca(OH)2],发生的反应为CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,发生的反应为Mg2++2OH-=Mg(OH)2↓,所以加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2,故D正确;
CaO+CO2↑、CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,发生的反应为Mg2++2OH-=Mg(OH)2↓,所以加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2,故D正确;
答案选D。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类错误的是( )
A.混合物:盐酸、生铁、空气
B.化合物:CaCl2、NaOH、HCl
C.碱:苛性钠、纯碱、氢氧化钾
D.单质:Ca、O3、石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为OH-+H+=H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为224mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
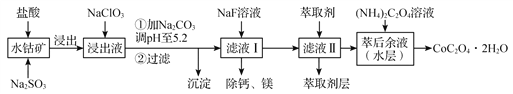
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O![]()
![]() +OH Kb=1.8×105;
+OH Kb=1.8×105;
H2C2O4![]() H++
H++![]() Ka1=5.4×102;
Ka1=5.4×102;
![]() H++
H++![]() Ka2=5.4×105。
Ka2=5.4×105。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含 NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______________________、_______________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①如果实验中没有E装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
②若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=![]() B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施(其他条件一定)不能增大反应速率的是( )
A.增大HCl溶液的浓度B.粉碎CaCO3固体
C.升高反应体系的温度D.减小反应体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A. 混合气体中含NO21.12 L B. 消耗氧气的体积为1.68 L
C. 此反应过程中转移的电子为0.3 mol D. 参加反应的硝酸是0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com