
【题目】完成下列填空。
(1)在 25℃、101kPa 时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为 393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则 2C(s)+2H2(g)+O2(g)= CH3COOH(l)的△H=___________。
(2)温度为 T 时,在 2 L 的密闭容器中加入 2.0 mol SO2 和 1.0 mol O2 发生反应,达到平衡时容器内气体压强变为起始时的 0.7 倍。该反应的平衡常数为_____。
(3)在一定体积 pH=12 的 Ba(OH)2 溶液中,逐滴加入一定物质的量浓度的 NaHSO4 溶液, 当溶液中的 Ba2+恰好完全沉淀时,溶液 pH=11。若反应后溶液的体积等于 Ba(OH)2 溶液与 NaHSO4 溶液的体积之和,则 Ba(OH)2 溶液与 NaHSO4 溶液____
(4)利用如图所示的电解装置,可将雾霾中的 NO、SO2 转化为硫酸铵,从而实现废气的回 收再利用。通入 NO 的电极反应式为_____;若通入的 NO 体积为 4.48 L(标况下),则理论上另一电极通入 SO2 的物质的量应为_________。

【答案】-488.3kJ∕mol 1620 1:4 NO+6H++5e-=NH4++H2O 0.5mol
【解析】
根据燃烧热写出热化学方程式,再利用盖斯定律来计算反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热;利用三段式法,设参加反应的SO2物质的量,用平衡状态时的压强变化列式求解,再用化学平衡公式求解化学平衡常数;氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1和反应,结合溶液的pH和溶液体积换算物质的量列式计算;根据电解装置分析,通入NO的电极连接外电源负极,则该电极为电解池阴极,电解池阴极发生还原反应,NO转化为NH4+,H+参与电极反应,据此写出电极方程式,根据电子守恒计算。据此分析。
(1)在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ∕mol、285.8kJ∕mol、870.3kJ∕mol,则H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ∕mol (1)
O2(g)=H2O(l) △H=-285.8kJ∕mol (1)
C(s)+O2(g)=CO2(g) △H=-393.5kJ∕mol (2)
CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ∕mol(3)
由盖斯定律可以知道,(1)×2+(2)×2-(3)可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热为2×(-285.8kJ∕mol)+2×(-393.5kJ∕mol)+870.3kJ∕mol=-488.3kJ∕mol,答案为:-488.3 kJ∕mol;
(2)温度为T时,在2L的密闭容器中加入2.0 mol SO2和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的0.7倍,用三段式法设反应的SO2的物质的量: ,该反应是恒温恒容下的反应,根据反应前后压强之比等于物质的量之比得
,该反应是恒温恒容下的反应,根据反应前后压强之比等于物质的量之比得![]() ,则化学平衡常数
,则化学平衡常数 ,答案为:1620;
,答案为:1620;
(3)pH=12的Ba(OH)2溶液中c(OH- )= 10-2mol∕L,设溶液体积为aL,则氢氧根离子物质的量为10-2×a mol;当溶液中的 Ba2+恰好完全沉淀时,根据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,反应的硫酸氢钠物质的量为0.5a×10-2mol;设硫酸氢钠溶液体积为bL,混合后溶液pH=11,得溶液中氢氧根离子浓度为10 -3mol∕L,碱过量;根据公式得:![]() ,a:b=1:4;答案为:1:4;
,a:b=1:4;答案为:1:4;
(4)根据电解装置,SO2转化为硫酸根离子,说明NO转化为NH4+,即NO在阴极发生还原反应NO+6H++5e-=NH4++H2O,阳极反应式为SO2+2H2O-2e-=4H++SO42-,通入的 NO体积为 4.48 L(标况下)即0.2mol,根据得失电子守恒,因此有2NO~10e-~5SO2,则SO2的物质的量为0.5mol,答案为:NO+6H++5e-=NH4++H2O;0.5mol;


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】用下列装置制备并检验Cl2的性质,下列有关说法正确的是( )

A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:充分光照后,量筒中剩余气体约为10 mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的 | 实验方案 | 所选玻璃仪器 | |
A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
B | 证明CH3COOH与HClO的酸性强弱 | 相同温度下用pH试纸测定浓度均为0.1 mol·L-1NaClO、CH3COONa溶液的pH | 玻璃棒、玻璃片 |
C | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1 g·mL-1) | 将25 g CuSO4·5H2O溶解在975 g水中 | 烧杯、量筒、玻璃棒 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:

已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO42-)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO42-会发生自身氧化还原反应,生成MnO4-和MnO2。
回答下列问题:
(1)KOH的电子式为______,煅烧KOH和软锰矿的混合物应放在_______中加热(填标号)。
a.烧杯 b.瓷坩埚 c.蒸发皿 d.铁坩埚
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为______。
(3)趁热过滤的目的是_______________________________。
(4)已知20℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1g、34g、217g,则从理论上分析,选用下列酸中__________(填标号),得到的高锰酸钾晶体纯度更高。
a.稀硫酸 b.浓盐酸 c.醋酸 d.稀盐酸
(5)产品中KMnO4的定量分析:
①配制浓度为0.1250mg·mL-1的KMnO4标准溶液100mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③称取KMnO4样品(不含K2MnO4)0.1250g按步骤①配得产品溶液1000mL,取10mL稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为____。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.Y的核外电子排布式为![]()
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式为
C.因硫元素电负性比磷元素大,故硫元素第一电离能比磷元素第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
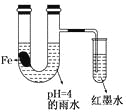
A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
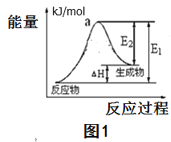
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:
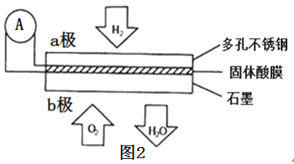
①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com