
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
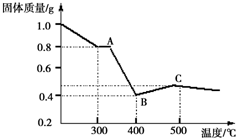
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol,
故答案为:还原性;0.6;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)【定性研究】实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:
| 实验步骤(不要求写出具体操作程) | 预期实验现象和结论 |
| 加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可乐饮料中含有的兴奋性物质咖啡因(C8H10O2N4)属于有机物 | |
| B. | 医疗上,碳酸氢钠是治疗胃穿孔的一种药剂 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 日常食用的冰糖、麦芽糖都属于单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该过程中有极性键的断裂和形成 | B. | 该过程中的X和Y均为活化分子 | ||
| C. | 加入催化剂能增大X和Y分子的能量 | D. | 该过程不能消除大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
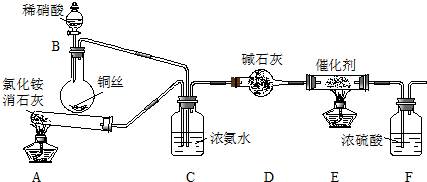

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
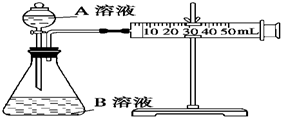 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 镁和盐酸的反应 | D. | 钠和水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com