

分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负极;
(2)A是电解氯化钾溶液,是放氢生成碱型,所以溶液的PH值变大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:增大;减小;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,故答案为:0.1mol•L-1.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只含有氨分子和水分子 | |
| B. | 只含有一水合氨分子和水分子 | |
| C. | 只含有氨分子、水分子和一水合氨分子 | |
| D. | 含有氨分子、水分子、一水合氨分子、铵根离子、氢离子和氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
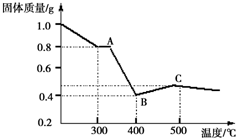 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
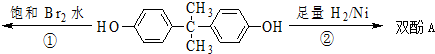
| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.92g | B. | 1.68g | C. | 2.12g | D. | 2.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2的总能量一定大于NH3的总能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | N2和H2的总能量一定低于NH3的总能量 | |
| D. | NH3的能量一定高于N2的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com