
| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
分析 A.据溶液pH计算出硫酸溶液中氢离子浓度,再计算出等体积混合后溶液中氢离子浓度及溶液的pH;
B.中和热是指生成1mol水;
C.电离平衡常数=$\frac{c({A}^{-})c({H}^{+})}{cHA)}$=1×10-7,则c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,电离度=$\frac{c(HA)_{电离}}{c(HA)_{总}}$×100%;
D.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,计算c(Ag+)、c(CrO42-),结合Ksp=1.12×10-12判断是否生成沉淀.
解答 解:A.pH=3的硫酸溶液中氢离子浓度为0.001mol/L,pH=5的硫酸溶液中氢离子浓度为1×10-5mol/L,等体积混合后溶液中氢离子浓度为:$\frac{1}{2}$×(0.001mol/L+1×10-5mol/L)=5.05×10-4mol/L,溶液的pH=-lgc(H+)=-lg5.05×10-4≈3.3,故A正确;
B.中和热是指生成1mol水,热化学方程式应为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(1),△H=-57.3kJ•mo1-l,故B错误;
C.电离平衡常数=$\frac{c({A}^{-})c({H}^{+})}{cHA)}$=1×10-7,则c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,电离度=$\frac{c(HA)_{电离}}{c(HA)_{总}}$×100%=$\frac{1{0}^{-4}mol/L}{0.1mol/L}×100%$=0.1%,故C错误;
D.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,c(Ag+)=c(CrO42-)=1×10-4mol•L-1,c2(Ag+)×c(CrO42-)=1×10-12mol•L-1<1.12×10-12,则没有沉淀生成,故D错误.
故选A.
点评 本题考查了水的电离及溶液pH的简单计算,题目难度中等,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养,注意掌握溶液酸碱性的判断方法及溶液pH的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 都可以用 | B. | 只能用③ | C. | 可以用①或② | D. | 可以用③或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
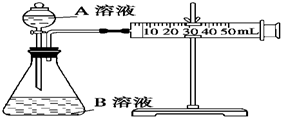 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com