
| A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时,4OH-+3SO2= SO32—+2HSO3—+H2O |
| B.CuCl2溶液与Na2S溶液2∶1反应:Cu2++S2-=CuS↓ |
| C.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2)=1∶1时:2Fe2++4Br-+3Cl2 =2Fe3++2Br2+6Cl- |
| D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的盐酸等体积互相均匀混合:2AlO2—+5H+=Al(OH)3↓+Al3++H2O |
科目:高中化学 来源:不详 题型:单选题
A.氨水使酚酞溶液变红:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.醋酸使碳酸钙溶解:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 KI3
KI3| A.Na2S2O3 | B.AlCl3 |
| C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
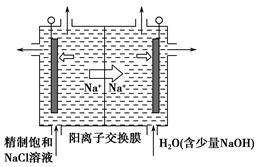
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.84消毒液与洁厕灵混合可能产生毒气: ClO- + Cl- + 2H+ = Cl2↑ + H2O |
| B.用二氧化硅和水反应可制得硅酸: SiO2 + H2O = H2SiO3 |
| C.食醋与蛋壳反应: CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O |
| D.铁在氯气中燃烧: Fe + Cl2 = FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 |
| B.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
C.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4 +H2O +H2O |
D.用小苏打类药物治疗胃酸过多:HCO3-+H+=CO2 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑ |
| B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2- + 5 H+=Al(OH)3↓+Al3++H2O |
| C.碳酸氢钠溶液与少量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+ 2H+ = H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O=2Fe(OH)2 |
| B.SO2使紫色石蕊溶液变红色:SO2+H2O=SO32-+2H+ |
| C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
| D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com