
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
分析 (1)结合V(NaOH)=$\frac{(18.60-0.5)+(19.00-0.7)}{2}$=18.2mL、c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$计算;
(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色;
(3)结合c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$及不当操作使V(NaOH)偏大,则测定结果偏高,以此来解答.
解答 解:(1)由表格数据可知V(NaOH)=$\frac{(18.60-0.5)+(19.00-0.7)}{2}$=18.2mL、c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$=$\frac{0.2mol/L×0.0182L}{0.01L}$=0.364mol/L,
故答案为:0.364;
(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色,则达到滴定终点的标志是无色变为红色,且30s内不变色,
故答案为:无色变为红色,且30s内不变色;
(3)A.未用标准液润洗碱式滴定管,消耗V(NaOH)偏大,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏高,故A选;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,V(NaOH)偏小,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏低,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,HCl的物质的量不变,消耗NaOH的物质的量不变,对实验无影响,故C不选;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.V(NaOH)偏大,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏高,故D选;
故答案为:AD.
点评 本题考查中和滴定实验,为高频考点,把握滴定原理、数据处理、误差分析为解答的关键,侧重分析与实验能力的考查,注意结合实验中不当操作分析误差,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 ,K的结构简式为
,K的结构简式为 .
.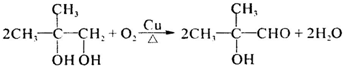 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨工业中,加压有利于提高NH3的产率 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效率好 | |
| C. | 化石燃料包括石油、天然气、煤和氢能 | |
| D. | 在时间允许的情况下,从节能上分析,步行>坐公交>坐出租车 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com